摘要:混合溶液: ⑴0.01mol/L的盐酸与0.01mol/L 的氨水等体积混合: ⑵0.01mol/L的盐酸与0.02mol/L 的氨水等体积混合: ⑶0.01mol/L的NaOH溶液与0.02mol/L 的醋酸等体积混合: ⑷0.01mol/L的NaOH溶液与0.02mol/L 的HCN溶液等体积混合: ⑸pH=10的NaOH溶液与pH=4的醋酸等体积混合: ⑹0.01mol/L的Na2CO3溶液与0.01mol/L的NaHCO3溶液等体积混合 [例7]⑴等体积的下列溶液中.阳离子的总物质的量最大的是:①0.2mol/L的CuSO4溶液.②0.1mol/L的Na2CO3溶液.③0.2mol/L的KCl溶液.④0.1mol/L的Na2SO4溶液. ⑵浓度为0.100mol/L的下列各物质的溶液中.c(NH4+)由大到小的顺序是 ①NH4Cl ②NH4HSO4 ③ NH3·H2O ④CH3COONH4 [反馈练习]
网址:http://m.1010jiajiao.com/timu_id_4401521[举报]
对于常温下PH为2的盐酸,叙述正确的是( )
| A、c(H+)=c(Cl-)+c(OH-) | B、由H2O电离出的c(H+)=1.0×10-12mol?L-1 | C、与等体积PH=12的氨水混合后所得溶液显酸性 | D、与等体积0.01mol?L-1乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-) |
对于常温下pH为2的盐酸,叙述正确的是
[ ]
A.c(H+)=c(Cl-)+c(OH-)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10-12mol/L
D.与等体积0.01mol/L乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
查看习题详情和答案>>
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10-12mol/L
D.与等体积0.01mol/L乙酸钠溶液混合后所得溶液中:c(Cl-)=c(CH3COO-)
下列说法正确的是
A.0.01mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,所得溶液中c(H+)=c(OH-)
B.氯水中离子浓度大小关系是:c(H+)>c(Cl-)>c(OH-)>c(ClO-)
C.25℃时,将pH=a的醋酸溶液稀释10倍后,溶液的pH=b,则a>b
D.25℃时,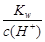 =0.1mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
=0.1mol·L-1的溶液中,Na+、CO32-、Cl-一定能大量共存
查看习题详情和答案>>
(1)常温下,已知0.1mol?L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.
①常温下,0.1mol?L-1 HA溶液的pH=
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH
(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
查看习题详情和答案>>
①常温下,0.1mol?L-1 HA溶液的pH=
3
3
;写出该酸(HA)与NaOH溶液反应的离子方程式:HA+OH-═A-+H2O
HA+OH-═A-+H2O
;②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
c(A-)>c(Na+)>c(H+)>c(OH-)
c(A-)>c(Na+)>c(H+)>c(OH-)
. (2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH
<
<
14-a(>、<、=)(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是
Mn2+
Mn2+
,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+)450
450
.(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
Ka?Kh=Kw
Ka?Kh=Kw
.