摘要: “转换 策略建奇功 转换策略源于辩证思维.事物都是普遍联系的.一般中存在着特殊.特殊中也反映着一般.有些命题若从一般情况考虑很难得出结论.此时不妨将问题转换到特殊的情形上加以审视.通过特殊看一般.结论常常跃然而出. [例1] 和组成的混合物中.氢元素的质量分数为1.3%.则钠元素的质量分数为( ) A. 68.2% B. 58.2% C. 40.5% D. 23% [解析]观察和的化学式后.我们发现二者存在相似的地方.所以可以转换二者的分子式.以为参照将NaOH进行变形:.那么混合物中实际的和虚拟的质量分数和为:.从而得出. 答案选B.
网址:http://m.1010jiajiao.com/timu_id_4400020[举报]
1991年8月,世界各国太阳能专家聚集巴黎,专门讨论了太空太阳能电站问题。这种空间太阳能电站建在地球同步轨道的一个固定位置上,向地球上固定区域供电。其发电及传输示意图如图1-6-4所示。在太阳能收集板上铺设太阳能电池,通过光电转换把太阳能转变成电能,再经微波转换器将直流电转换成微波,并通过天线将电能以微波形式向地面发送,地面接收站通过整流天线把微波能还原成电能。

图1-6-4
制造太阳能电池需要高纯度的硅,工业上由粗硅制高纯度硅常通过以下反应实现:
①Si(s)+3HCl(g)![]() SiHCl3(g)+H2(g);ΔH=-381 kJ
SiHCl3(g)+H2(g);ΔH=-381 kJ
②SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g)
Si(s)+3HCl(g)
(1)元素硅在周期表中位于__________;晶体硅属于__________晶体,是__________ (填“导体”“半导体”或“绝缘体”);晶体硅有类似金刚石的结构,每摩尔晶体硅的共价键数目为____________________,键角为__________。
(2)关于上述条件下的两个反应的叙述不正确的是( )
A.两个反应都是置换反应 B.反应②是放热反应
C.上述反应是可逆反应 D.两个反应都是氧化还原反应
(3)反应②的热效应为____________________。
查看习题详情和答案>>硝酸与金属反应是硝酸的重要化学性质之一,请阅读下文并解答有关问题.
(1)ag铜与bmL浓HNO3充分反应后得到V1L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子.)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量.
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐.
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度.
查看习题详情和答案>>
(1)ag铜与bmL浓HNO3充分反应后得到V1L红棕色气体X,且溶液中余下cg铜;再将此红棕色气体通过水变成V2L无色气体Y(气体已转换成标准状况下的体积,设题中产生的氮的化合物分子中均含有一个氮原子.)
①当反应生成X气体时有多少克氮元素被还原?
②计算X气体中各组分的物质的量.
(2)若在(1)反应余下的溶液中加入过量的稀H2SO4使留下的cg铜恰好完全溶解;此时溶液中只留下一种盐.
①写出此时发生的化学反应方程式
②计算a与c的质量比及浓HNO3的物质的量浓度.
利用如图1所示实验装置可以测定一条条件下1mol气体的体积,图1中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.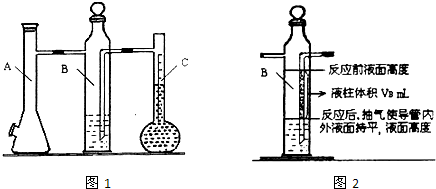
实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞, 可以确认装置气密性合格.
(2)B中所装液体一般是 (填“水”或“品红”).A中发生反应的离子方程式为 .
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
①上表中X= .
②计算1mol氢气体积两次实验的平均值= L.
③计算实验误差:(实验值-理论值)/理论值×100%= .
④引起该误关的可能原因 (填字母).
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是 (合理则填序号,否则填“无”).如有合理之处,请根据下面的数据给出修正的1mol氢气体积的数学表达式.(镁元素的相对原子质量为24.3)
1mol氢气体积= L(填写数学表达式).
查看习题详情和答案>>

实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,
(2)B中所装液体一般是
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
②计算1mol氢气体积两次实验的平均值=
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误关的可能原因
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |
化学与社会、生产、生活密切相关.下列说法正确的是( )
| A、可以用物理方法或化学方法从海水中提取所需物质 | B、用激光笔分别照射盛有牛奶、食盐水的玻璃杯,都有光亮的通路 | C、神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 | D、氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 |