摘要:NA 代表阿伏加德罗常数.下列叙述错误的是 ( ) A. 10 mL 质量分数为 98 %的 H2SO4.用水稀释至 100 mL H2SO4 的质量分数为 9.8 % B. 在 H2O2 + Cl2 = 2HCl + O2 反应中.每生成 32g氧气.则转移 2 NA 个电子 C.标准状况下.分子数为NA的 CO .C2H4 混合气体体积约为 22.4L .质量为 28g D.一定温度下. 1 L 0.5 mol/L NH4Cl 溶液与 2 L 0. 25mol/L NH4Cl 溶液含 物质的量不同 [解析]A中根据C=1000dω/W.其中d是溶液密度.ω是溶液质量分数.稀释至100ml.物质的量浓度变为原来的1/10.又硫酸溶液的浓度越大.密度越大.所以H2SO4 的质量分数大于 9.8 %,B中根据反应可知H2O2全部作还原剂.所以每生成 32g氧气即1mol.则转移 2 NA 个电子,C中注意CO .C2H4的式量相等,D中两份溶液中铵根离子的浓度不同.水解程度不同.所以NH4+ 物质的量不同21世纪教育网 [答案]A [考点分析]本题以阿伏伽德罗常数的考查为载体.具体考查溶液的稀释.电子的转移.分子数与质量的关系.溶液中因水解程度不同离子浓度的不同等知识点.
网址:http://m.1010jiajiao.com/timu_id_4394721[举报]
(2008?山东)氮是地球上极为丰富的元素.
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为
(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,计算说明N2中的
(3)(CH3)3NH+和AlCl4-可形成离子液体.离子液体由阴阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示.X的元素符号是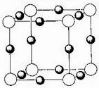
查看习题详情和答案>>
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为
1S22S22P6
1S22S22P6
.(2)N≡N的键能为942kJ?mol-1,N-N单键的键能为247kJ?mol-1,计算说明N2中的
π
π
键比σ
σ
键稳定.(填“σ”或“π”)(3)(CH3)3NH+和AlCl4-可形成离子液体.离子液体由阴阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
小
小
(填“大”或“小”),可用作b
b
(填代号).a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示.X的元素符号是
Cu
Cu
,与同一个N3-相连的X+有6
6
个.
(08年山东卷)下列叙述合理的是()
A.金属材料都是导体,非金属材料都是绝缘体
B.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
C.水电站把机械能转化成电能,而核电站把化学能转化成电能
D.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”
查看习题详情和答案>>
(08年山东卷)氮是地球上极为丰富的元素。
⑴Li3N晶体中氮以N3-的存在,基态N3-的电子排布式为 。
⑵N≡N的键能为942 kJ?mol-1,N-N单键的键能为247 kJ?mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
⑶(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 (填代号)
 a.助燃剂
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
⑷X+中所有电子正好充满KLM三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的X+有 个。
查看习题详情和答案>>(2008?山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
查看习题详情和答案>>
(1)冶炼铜的反应为:
8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
Cu、O
Cu、O
(填元素符号).(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是
b、c
b、c
(填代号).a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:
2Fe3++2I-=2Fe2++I2
2Fe3++2I-=2Fe2++I2
、S2O82-+2Fe2+=2SO42-+2Fe3+
S2O82-+2Fe2+=2SO42-+2Fe3+
(不必配平)(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是
2Al3++4OH-=AlO2-+2H2O
2Al3++4OH-=AlO2-+2H2O
.b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为
稀硫酸、KMnO4溶液
稀硫酸、KMnO4溶液
.证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
.(2008?山东)食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
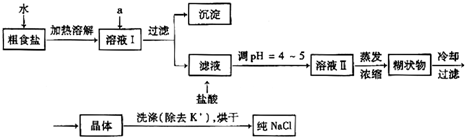
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为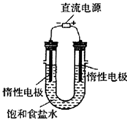
(2)用提纯的NaCl配制500mL4.00mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置
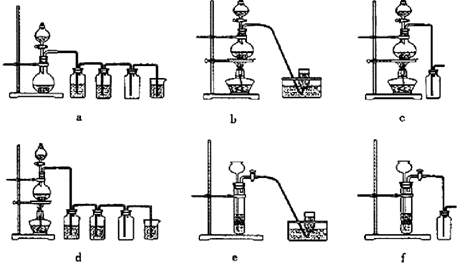
查看习题详情和答案>>
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
BaCl2、NaOH、Na2CO3
BaCl2、NaOH、Na2CO3
(只填化学式).②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
75%乙醇
75%乙醇
.
(2)用提纯的NaCl配制500mL4.00mol?L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有
天平、烧杯、500mL容量瓶、胶头滴管
天平、烧杯、500mL容量瓶、胶头滴管
(填仪器名称).(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2
<
<
(填“>”、“=”或“<”)2L,原因是电解生成的氯气与电解生成的NaOH发生了反应
电解生成的氯气与电解生成的NaOH发生了反应
.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是中和滴定
中和滴定
.(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓)
| ||
据此,从下列所给仪器装置中选择制备并收集H2的装置
e
e
(填代号)和制备并收集干燥、纯净Cl2的装置d
d
(填代号).可选用制备气体的装置: