摘要:5. 在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是 ( ) a.体积②>③>①>④ b.密度②>③>④>① c.质量②>③>①>④ d.氢原子个数①>③>④>② A.abc B.bcd C.acd D.abcd [解析]比较a.c.d时先将不同的物理量转化为物质的量再进行比较.密度直接根据同温同压下.密度之比等于气体的式量之比.直接根据式量判断即可. [答案]D [考点分析]本题以物质的量为载体.考查物质的量与其他几个物理量之间的关系.同时考查学生对阿伏伽德罗定律及其推论的应用能力21世纪教育网
网址:http://m.1010jiajiao.com/timu_id_4394716[举报]
(2008?镇江二模)下列图1中B是一种常见的无色无味的液体.C是一种有磁性的化合物,E是一种无色无味的有毒气体.根据下列图1、图2,回答下列问题:

(1)写出C的化学式:
(2)E和N2是等电子体,请写出可能E的电子式:
 .
.
(3)在101kPa和150℃时,可逆反应E(g)+B(g) F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
A.升高温度 B.增大压强 C.加入催化剂
(4)若G是一种淡黄色固体单质,16g G和足量的A反应放出的热量为Q kJ(Q>0),写出这个反应的热化学方程式:
若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式:
查看习题详情和答案>>

(1)写出C的化学式:
Fe3O4
Fe3O4
.(2)E和N2是等电子体,请写出可能E的电子式:


(3)在101kPa和150℃时,可逆反应E(g)+B(g)
 F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F(g)+D(g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)B、C
B、C
. A.升高温度 B.增大压强 C.加入催化剂
(4)若G是一种淡黄色固体单质,16g G和足量的A反应放出的热量为Q kJ(Q>0),写出这个反应的热化学方程式:
S(s)+Fe(s) =FeS(s);△H=-2Q kJ?mol-1
S(s)+Fe(s) =FeS(s);△H=-2Q kJ?mol-1
.若G是一种气态单质,H的水溶液可以和有机物I反应使溶液呈紫色,请写出I的结构简式:
C6H5OH
C6H5OH
;H的水溶液呈酸性,请用离子方程式表示呈酸性的原因:Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
 Fe(OH)3+3H+
Fe(OH)3+3H+Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
. Fe(OH)3+3H+
Fe(OH)3+3H+(2008?镇江二模)世界环保组织2006年度报告指出,人类已成功地使大气中氟氯烃减少,但C、N、S氧化物的排放有增无减,水资源的紧缺和污染加剧.
(1)大气中氟氯烃的减少带来的积极效应是
(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:
②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:
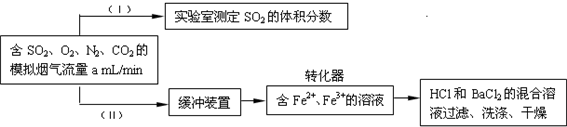
①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
查看习题详情和答案>>
(1)大气中氟氯烃的减少带来的积极效应是
减缓臭氧层空洞的增大
减缓臭氧层空洞的增大
.(2)酸雨的特征是pH<5.6,空气中硫氧化物和氮氧化物是形成酸雨的主要物质.
①若用NOX表示氮氧化物,请配平氮氧化物形成酸雨的化学方程式:

②酸雨落至地面后pH在一定时间内变小然后稳定于某一数值,原因是H2SO3受空气影响造成的,其化学方程式为:
2H2SO3+O2=2H2SO4
2H2SO3+O2=2H2SO4
.(3)回收利用SO2既能减少大气污染,又能充分利用资源.已知:用Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2 的回收利用.某同学设计测定转化器的脱硫效率方案如下:

①在实验①(Ⅰ)中,为了确定SO2 的体积分数,可将模拟烟气缓慢通过已知体积和浓度的
高锰酸钾溶液(或碘水和淀粉的混合液)
高锰酸钾溶液(或碘水和淀粉的混合液)
溶液,并用溶液的颜色刚好褪去时所消耗的模拟烟气的体积(标况下)来计算SO2 的体积分数.②在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
实验时间
实验时间
和BaSO4的质量
BaSO4的质量
.
