摘要:4..用NA表示阿伏加德罗常数的值.下列说法正确的是 A.标准状况下.5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA B.1 mol乙烷分子含有8 NA个共价键 C.58.5 g氯化钠固体中含有NA个氯化钠分子 D.在1 L 0.1 mol/L碳酸钠溶液中阴离总数大于0.1 NA [解析]考察阿伏加德罗常数.A中NO和O2会反应生成NO2,B中乙烷共价键有7NA, C中氯化钠含2NA个离子,D中碳酸钠因水解而使阴离子增加. [答案]D [考点分析]以阿伏伽德罗常数的计算为背景考查:气体摩尔体积的应用.物质中的共价键数.判断晶体类型以及水解反应对溶液中微粒数的影响.
网址:http://m.1010jiajiao.com/timu_id_4394715[举报]
(2009?浙江模拟)将一定量的Fe、Fe2O3和CuO的混合物,放入体积为100mL物质的量浓度为2.2mol/L的H2SO4溶液中,充分反应后,生成气体896mL(标准状况),得到不溶固体1.28g.过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为100mL).向滤液中加入2mol/L NaOH溶液至40mL时开始出现沉淀.则未滴加NaOH溶液前滤液中FeSO4的物质的量浓度为( )
查看习题详情和答案>>
(2009?浙江)单晶硅是信息产业中重要的基础材料.通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
请回答下列问题:
(1)写出装置A中发生反应的离子方程式
(2)装置A中g管的作用是
装置E中的h瓶需要冷却的理由是
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
查看习题详情和答案>>

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
(1)写出装置A中发生反应的离子方程式
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(2)装置A中g管的作用是
平衡压强,使液体顺利流出并防止漏气
平衡压强,使液体顺利流出并防止漏气
;装置C中的试剂是浓硫酸
浓硫酸
;装置E中的h瓶需要冷却的理由是
产物SiCl4沸点低,需要冷凝收集
产物SiCl4沸点低,需要冷凝收集
.(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
Al、P、Cl
Al、P、Cl
(填写元素符号).(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?
否
否
(填“是”或“否”),请说明理由KMnO4溶液的紫红色可指示反应终点
KMnO4溶液的紫红色可指示反应终点
.②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/LKMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是
4.480%
4.480%
.(2009?浙江模拟)某化工厂生产皓矾(ZnSO4?7H2O),结晶前的饱和溶液(呈酸性)中含有少量Cu2+、Fe3+、Fe2+等杂质.已知0.01mol/L的Fe3+开始沉淀到完全沉淀的pH范围是2.7~3.7;ZnSO4饱和溶液(0.34mol/L)中Zn2+开始沉淀到完全沉淀的pH范围是5.7~8.0;当pH<5.7时,Na2CO3、ZnCO3发生酸解生成CO2.该厂除杂及生产的工艺流程如图所示:
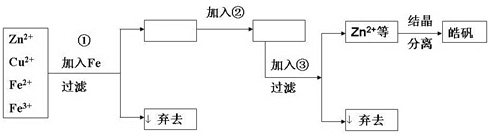
(1)加入的试剂②最好是
(2)为了调整溶液的pH,加入试剂③,供选用的试剂有NaOH、Na2CO3、ZnCO3、NH3?H2O、Ca(OH)2等,应当选用
(3)从溶液中获得皓矾的操作依次是
查看习题详情和答案>>

(1)加入的试剂②最好是
过氧化氢
过氧化氢
(填名称),其主要作用是将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
.(2)为了调整溶液的pH,加入试剂③,供选用的试剂有NaOH、Na2CO3、ZnCO3、NH3?H2O、Ca(OH)2等,应当选用
ZnCO3
ZnCO3
,理由是能控制pH在5.7附近,且不引入杂质离子
能控制pH在5.7附近,且不引入杂质离子
.(3)从溶液中获得皓矾的操作依次是
蒸发、冷却、过滤、洗涤
蒸发、冷却、过滤、洗涤
.(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看习题详情和答案>>