摘要:(二)根据2Fe+3Cl2 2FeCl3.Fe+S FeS.可知氧化性:Cl2>S.
网址:http://m.1010jiajiao.com/timu_id_4394572[举报]
(2009?淮安二模)根据下列框图回答问题:

已知白色固体N中阴、阳离子具有相同的核外电子层结构.
(1)请写出M与N反应的离子方程式:
(2)写出由A在空气中锻烧的化学方程式
(3)某同学取H的溶液,通入气体B,所得溶液中仍只有一种阴离子.请写出上述变化过程中的离子方程式
(4)类似上述框图中A、B、C之间的转化关系一般可以表示为(副产物已略去):

则下列说法正确的是
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
d.若X是强碱,则C可能是正盐或酸式盐.
查看习题详情和答案>>

已知白色固体N中阴、阳离子具有相同的核外电子层结构.
(1)请写出M与N反应的离子方程式:
Fe 2++S 2-=FeS↓
Fe 2++S 2-=FeS↓
.(2)写出由A在空气中锻烧的化学方程式
4FeS+7O2
2Fe2O3+4SO2
| ||
4FeS+7O2
2Fe2O3+4SO2
.
| ||
(3)某同学取H的溶液,通入气体B,所得溶液中仍只有一种阴离子.请写出上述变化过程中的离子方程式
2Fe 3++SO2+2H2O=2Fe 2++SO4 2-+4H+
2Fe 3++SO2+2H2O=2Fe 2++SO4 2-+4H+
.(4)类似上述框图中A、B、C之间的转化关系一般可以表示为(副产物已略去):

则下列说法正确的是
abcd
abcd
a.若A是非金属单质,则C与水反应的生成物可能是强酸或弱酸
b.若A是金属单质,则C与水反应的生成物可能是强碱
c.若A是化合物,则C与水反应的生成物可能是强酸
d.若X是强碱,则C可能是正盐或酸式盐.
 铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂.
铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂.(1)合成氨工业使用的催化剂是以铁为主体的多成分催化剂.
①NH3中N原子的杂化轨道类型是
sp3
sp3
.②N与O同属第二周期,N的第一电离能比O大的原因是
N原子失去的1个电子是相对稳定的半充满的2p能级上的电子,需要提供额外的能量,而O原子失去电子来自2p4构型,相对于2p3构型而言稳定性较差
N原子失去的1个电子是相对稳定的半充满的2p能级上的电子,需要提供额外的能量,而O原子失去电子来自2p4构型,相对于2p3构型而言稳定性较差
.③根据等电子体原理,写出一种和NH4+是等电子体的微粒的化学式
CH4
CH4
.(2)二茂铁[(C5H5)2Fe]是一种金属有机配合物,是燃料油的添加剂,
用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如图1所示,其中氢原子的化学环境完全相同.
①Fe的基态原子电子排布式为
[Ar]3d64s2或1s22s22p63s23p63d64s2
[Ar]3d64s2或1s22s22p63s23p63d64s2
.②二茂铁中Fe2+与环戊二烯离子(C5H5-)之间的化学键类型是
配位键
配位键
.③1mol环戊二烯(
 )中含有σ键的数目为
)中含有σ键的数目为11NA
11NA
个.(3)普鲁士蓝俗称铁蓝,结构如图2所示(K+未画出),每隔一个立方体在立方体中心含有一个K+离子,普鲁士蓝中铁元素的化合价有+2和+3两种,其中Fe3+与Fe2+的个数比为:
1:1
1:1
.(2009?广州二模)利用铝热反应焊接钢轨的原理是2Al+Fe2O3
2Fe+Al2O3.某研究小组在实验室利用简易装置进行铝热反应.发现生成的铁呈疏松的褐色硬块.小组成员推测主要原因是产物铁含杂质较多,并进一步探究褪褐色硬块的组成.
(1)将褐色硬块处理成粉末状.研究小组首先排除了含有单质Al杂质的可能性,实验方法是
(2)该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3.请以上述粉末为样品,验证其组成.限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水.
根据你设计的实验方案,叙述实验操作、预期现象和结论.
查看习题详情和答案>>
| ||
(1)将褐色硬块处理成粉末状.研究小组首先排除了含有单质Al杂质的可能性,实验方法是
取少量粉末加入NaOH溶液中
取少量粉末加入NaOH溶液中
,证明不含单质铝的现象是无气泡冒出
无气泡冒出
.(2)该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3.请以上述粉末为样品,验证其组成.限选实验仪器与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、过滤器;20%KSCN、3mol/LNaOH、3mol/LHCl、3mol/LHNO3、3mol/LCuSO4、0.01mol/LKMnO4、蒸馏水.
根据你设计的实验方案,叙述实验操作、预期现象和结论.
| 实验操作 | 预期现象和结论 |
| 步骤1: | 粉末减少,说明粉末国可能含有Al2O3 粉末减少,说明粉末国可能含有Al2O3 |
| 步骤2: | 有白色沉淀产生然后沉淀又溶解,说明粉末中含有Al2O3 有白色沉淀产生然后沉淀又溶解,说明粉末中含有Al2O3 |
| 步骤3: | 有红色固体生成,说明粉末中含有Fe 有红色固体生成,说明粉末中含有Fe |
| 步骤4: | 固体部分溶解,溶液变血红色,说明粉末中含有Fe2O3 固体部分溶解,溶液变血红色,说明粉末中含有Fe2O3 |
某研究小组对铁生锈进行研究: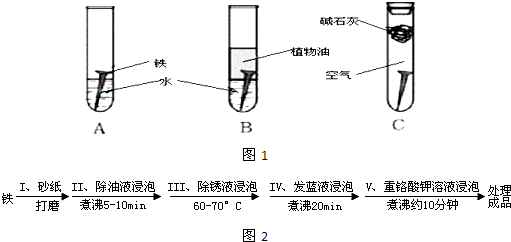
(1)经过较长时间后,甲同学观察到的现象是:图1中的铁钉最容易生锈的是
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
(3)铁生锈的外部条件是
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
A.锡 B.铜 C.锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀.所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜.发蓝处理过程可表示如图2所示:
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:
反应二:8Fe+3NaNO3+5NaOH+2H2O=4Na2Fe2O4+3NH3↑
反应三:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上).若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中
A.只需加入NaNO2
B.只需加入NaNO2和NaNO3
C.需要加入NaNO2、NaNO3和NaOH
D.不需加入任何物质而直接使用.
查看习题详情和答案>>

(1)经过较长时间后,甲同学观察到的现象是:图1中的铁钉最容易生锈的是
A
A
(填字母),铁锈的主要成分是Fe2O3(或Fe2O3?xH2O)
Fe2O3(或Fe2O3?xH2O)
.(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(3)铁生锈的外部条件是
潮湿的空气(或氧气与水)
潮湿的空气(或氧气与水)
;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为2Fe+O2+2H2O=2Fe(OH)2
2Fe+O2+2H2O=2Fe(OH)2
.(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是
C
C
.A.锡 B.铜 C.锌
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀.所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜.发蓝处理过程可表示如图2所示:
①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为
Fe2O3+6H+=2Fe3++3H2O
Fe2O3+6H+=2Fe3++3H2O
.②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为
铁制品表面有红色固体析出
铁制品表面有红色固体析出
.③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:
3
3
Fe+1
1
NaNO2+5
5
NaOH-3
3
Na2FeO2+1
1
H2O+1
1
NH3↑反应二:8Fe+3NaNO3+5NaOH+2H2O=4Na2Fe2O4+3NH3↑
反应三:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上).若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中
A
A
.A.只需加入NaNO2
B.只需加入NaNO2和NaNO3
C.需要加入NaNO2、NaNO3和NaOH
D.不需加入任何物质而直接使用.
为测定硫酸亚铁铵晶体【(NH4)2Fe(SO4)2?xH2O】中铁的含量,某实验小组做了如下实验:
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、
(2)用
(3)当滴入最后一滴KMnO4溶液,出现
(4)滴定结果如下表所示:
实验测得该晶体中铁的质量分数为
(5)根据步骤二填空:
①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将
②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将
③滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化B、锥形瓶内溶液颜色的变化
④滴定后俯视读数,测得样品中铁的质量分数将
查看习题详情和答案>>
步骤一:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,用0.010mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4-被还原成Mn2+.
再重复步骤二两次.
请回答下列问题:
(1)配制硫酸亚铁铵溶液的操作步骤依次是:称量、
溶解
溶解
、转移、洗涤并转移、定容
定容
、摇匀.(2)用
酸式
酸式
滴定管盛放KMnO4溶液.(3)当滴入最后一滴KMnO4溶液,出现
溶液由黄色变成紫红色,且半分钟内不褪色
溶液由黄色变成紫红色,且半分钟内不褪色
,即到达滴定终点.反应的离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
11.20%
11.20%
.(保留两位小数)(5)根据步骤二填空:
①滴定管用蒸馏水洗涤后,直接加入KMnO4标准溶液进行滴定,则测得样品中铁的质量分数将
偏高
偏高
.(填“偏高”、“偏低”或“无影响”).②锥形瓶用蒸馏水洗涤后,未干燥,则滴定时用去KMnO4标准溶液的体积将
无影响
无影响
(填“偏大”、“偏小”或“无影响”).③滴定时边滴边摇动锥形瓶,眼睛应观察
B
B
.A、滴定管内液面的变化B、锥形瓶内溶液颜色的变化
④滴定后俯视读数,测得样品中铁的质量分数将
偏低
偏低
(填“偏高”、“偏低”或“无影响”).