摘要:4.原子光谱 ⑴基态:电子按构造原理的顺序进入原子核外的轨道.此时整个原子的能量最低.称之为基态. 基态原子是处于最低能量状态的原子. ⑵激发态:基态原子的电子吸收能量后.电子会跃迁到较高的能级.此时原子的能量较基态高.叫激发态. 基态和激发态间.不同激发态间能量是不连续的.像楼梯的台阶一样. ⑶电子的跃迁:电子由较高能量的激发态跃迁到较低能量的激发态或基态时.会放出能量.发光是释放能量的主要形式之一.反之.电子由较低能量的基态或激发态跃迁到激发态或能量较高的激发态时.会吸收能量.吸收光是吸收能量的形式之一. ⑷原子光谱:不同元素原子的电子发生跃迁时.会吸收或释放不同波长的光.可以用光谱仪来记录.鉴别.称之为原子光谱. 在现代化学中.利用不同元素的原子光谱上的特征谱线来鉴定元素.称为光谱分析.
网址:http://m.1010jiajiao.com/timu_id_4388422[举报]
 (2013?常州一模)A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.
(2013?常州一模)A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F.(1)写出B的基态原子的核外电子排布式
1s22s22p2
1s22s22p2
.(2)A、C形成的最简单分子极易溶于水,其主要原因是
NH3与H2O间能形成氢键
NH3与H2O间能形成氢键
;与该最简单分子互为等电子体的阳离子为H3O+
H3O+
.(3)比较E、F的第一电离能:E
>
>
F(选填“>”或“<”,“=”).(4)BD2在高温高压下所形成的晶胞如右图所示.该晶体的类型属于
原子
原子
(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为sp3
sp3
.(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在
acd
acd
.a.共价键 b.非极性键 c.配位键 d.σ键 e.π键.
 【化学--选修物质结构与性质】
【化学--选修物质结构与性质】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子.请回答下列问题:
(1)E元素基态原子的电子排布式为
1s22s22p63s23p1
1s22s22p63s23p1
.(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
C、O、N
C、O、N
(填元素符号).(3)D元素与氟元素相比,电负性:D
<
<
F(填“>”、“=”或“<”).(4)BD2在高温高压下所形成的晶体其晶胞如图所示.该晶体的类型属于
原子
原子
(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为sp3
sp3
.l mol B2A2分子中含σ键的数目是3NA(或1.806×1024)
3NA(或1.806×1024)
.(5)光谱证实单质E与强碱溶液反应有[E(OH)4]-生成,则[E(OH)4]-中存在
abc
abc
.a.共价键 b.配位键 c.σ键 d.π键.
(2012?石家庄一模)【化学一选修3:物质结构与性质】
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
请回答:
(1 )R基态原子的价电子排布图为 或
或
 或
或 ,R在周期表中位于
,R在周期表中位于
(2 )X、Y、Z的第一电离能由大到小的顺序为
(3)含有元素Q的盐的焰色反应为
(4)X的氯化物的熔点比Q的氯化物的熔点
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在
a.极性共价键 b.非极性共价键 c配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有
查看习题详情和答案>>
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
| X的基态原子中电子分布在三个不同的能级中,且每个能级的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化学反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578kJ?mol-1,I2=1817kJ?mol-1, I3=2745kJ?mol-1,I4=11575kJ?mol-1,I5=14830kJ?mol-1,I6=18376kJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表的第11列 |
(1 )R基态原子的价电子排布图为
 或
或
 或
或
ds
ds
区.(2 )X、Y、Z的第一电离能由大到小的顺序为
N>O>C
N>O>C
(用元素符号表示)(3)含有元素Q的盐的焰色反应为
紫
紫
色,许多金属盐都可以发生焰色反应,其原因是电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量
电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,以光的形式释放能量
(4)X的氯化物的熔点比Q的氯化物的熔点
低
低
(“高”或“低”),理由是固态CCl4属于分子晶体,而KCl属于离子晶体
固态CCl4属于分子晶体,而KCl属于离子晶体
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在
acd
acd
(填选项字母):a.极性共价键 b.非极性共价键 c配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石相似,硬度与金刚石相当,则金刚砂的晶胞中含有
4
4
个硅原子,4
4
个碳原子,其中硅原子的杂化方式为sp3
sp3
.(2011?扬州三模)(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
通常情况下,H2O2与水任意比互溶的主要原因是
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:R3+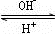 R(OH)3
R(OH)3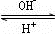 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为
查看习题详情和答案>>
F>Cl>S
F>Cl>S
(用元素符号表示)(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;A、B、C三种元素的原子半径由大到小的顺序是Na>Mg>Al
Na>Mg>Al
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
sp3
sp3
杂化;通常情况下,H2O2与水任意比互溶的主要原因是
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:R3+
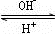 R(OH)3
R(OH)3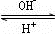 [R(OH)4]-
[R(OH)4]-①基态R原子的价电子排布式为
3d54s1
3d54s1
.②[R(OH)4]-中存在的化学键是BD
BD
.A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为
NH4OOH
NH4OOH
.已知A、B、C、D、E、F均为周期表中前36号元素,且原子序数依次增大.A、B、C为同一周期的主族元素,B原子p能级电子总数与s能级电子总数相等.A、F原子未成对电子是同周期中最多的,且F基态原子中电子占据三种不同形状的原子轨道.D和E原子的第一至第四电离能如下表所示:
(1)A、B、C三种元素的电负性最大的是
(2)F基态原子的核外电子排布式是
(3)根据等电子原理,写出AB+的电子式:
 .
.
(4)已知:F3+可形成配位数为6的配合物.组成为FCl3?6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为
A.[CrCl(H2O)5]Cl2?H2O B.[CrCl2(H2O)4]Cl?2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]?3H2O.
查看习题详情和答案>>
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
F
F
(填写元素符号),D、E两元素中D的第一电离能较大的原因是原子外围电子排布为3s2,s轨道全充满,相对稳定
原子外围电子排布为3s2,s轨道全充满,相对稳定
.(2)F基态原子的核外电子排布式是
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
;在一定条件下,F原子的核外电子从基态跃迁到激发态产生的光谱属于吸收
吸收
光谱(填“吸收”或“发射”).(3)根据等电子原理,写出AB+的电子式:


(4)已知:F3+可形成配位数为6的配合物.组成为FCl3?6H2O的配合物有3种,分别呈紫色、蓝绿色、绿色,为确定这3种配合物的成键情况,分别取等质量的紫色、蓝绿色、绿色3种物质的样品配成溶液,分别向其中滴入过量的AgNO3溶液,均产生白色沉淀且质量比为3:2:1.则绿色配合物的化学式为
[CrCl2(H2O)4]Cl?2H2O
[CrCl2(H2O)4]Cl?2H2O
.A.[CrCl(H2O)5]Cl2?H2O B.[CrCl2(H2O)4]Cl?2H2O
C.[Cr(H2O)6]Cl3 D.[CrCl3(H2O)3]?3H2O.