网址:http://m.1010jiajiao.com/timu_id_4386233[举报]
铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验步骤〗
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
【方案二】
〖实验方案〗将铝镁合金与足量稀硫酸 溶液反应,测定生成气体在通常状况(约20℃,1.01![]() 105Pa)的体积。
105Pa)的体积。
〖问题讨论〗(1)同学们拟选用下列实 验装置完成实验:
①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差: 稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
①装置中导管a的作用是
。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为__________mL。


(1)在图所示元素周期表中请用实线(黑色中性笔)画出主族元素的边界.

(2)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式


(3)在所有的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
(4)金属元素丙形成的某化合物的溶液常用于检验CO2,则元素丙的简单离子与元素甲的简单离子的半径大小关系是
(5)丁与戊分别是第三周期中简单离子半径最小和最大的金属元素,写出丁元素的单质与戊最高价氧化物对应的水化物溶液反应的离子方程式
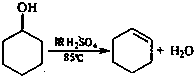
实验步骤下:
①在25mL干燥的圆底烧瓶中加入10g环己醇和0.5mL 98%浓硫酸,充分振荡.
②向烧瓶中放入2~3粒沸石,安装分馏装置,接收瓶用冰水冷却.
③小心加热,控制加热速度使温度不超过90℃,直到瓶底剩余少量残渣并出现白雾时停止加热.(已知:环己烯,沸点82.98℃;环己烯-10%水,沸点70.8℃;环己醇-80%水,沸点97.8℃:环己醇-30.5%环己烯,沸点64.9℃)
④向馏出液中加约1g精盐使其达饱和,然后加入2mL饱和碳酸钠水溶液,充分振荡.
⑤…
⑥有机层倒入干燥的小锥形瓶中,加入1~2g无水氯化钙干燥.待溶液清亮透明后过滤.
⑦将滤液移入圆底烧瓶中,加入2~3粒沸石,蒸馏.收集80~85℃馏分,称重约7.4g.
⑧计算.
请回答下列问题:
(1)步骤①中,加入10g环已醇和0.5mL 98%浓硫酸的顺序是
(2)步骤③中,为便干控制加热温度,应该采取的加热方法是
(3)步骤④中,向馏出液中加约1g精盐使其达饱和的目的是
(4)步骤⑤的操作是
(5)步骤⑧计算得到的环己烯的产率为
 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:| 元素编号 | 相 关 信 息 |
| U | 其核外电子总数等于其电子层数 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数均相等 |
| W | 其单质是空气的主要成分之一,且化学性质相当稳定 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离能 |
| Y | 其单质是最强的氧化剂 |
| Z | Z元素的二价阳离子与氩原子的电子层结构相同 |
| T | 是第四周期元素中未成对电子数最多的元素 |
(1)T的基态原子的价电子排布式为
(2)U、V两种元素可组成多种结构的分子.请写出符合下列条件的物质的结构简式:
若化合物V8U8中V元素均采取sp3杂化方式
若化合物V8U8中V元素均采取sp2杂化方式
(3)写出一种与V22-互为等电子体的分子的化学式为
(4)甲和乙分别是W、X元素对应的氢化物,甲和乙中均属于10电子分子,甲极易溶于乙中,原因是
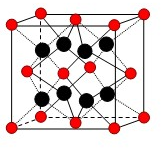
(5)ZY2晶体的晶胞如图所示,Z2+位于晶胞的顶点和面心,则Z2+的配位数为
)实验室制备溴苯可用如图所示的装置,填写下列空白:

(1)关闭F夹,打开C夹,在装有少量苯的三口烧瓶中由A口加入少量溴,再加入少量铁屑,塞住
A口,反应一段时间制的溴苯。溴苯是一种密度比水 (填”小”或”大”)的无色液体,在实
验中因为 而显褐色。则三口烧瓶中发生反应的化学方程式为__ ___和_ __。
(2)D、E试管内出现的现象为_____________________________________。
(3)待三口烧瓶中的反应进行到仍有气泡冒出时松开F夹,关闭C,可以看到的现象是
____________________________________。
(4)三口烧瓶中的溴苯经过下列步骤分离提纯:
①向三口烧瓶中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_ __。
(5) 经过上述分离操作后,粗溴苯中还含有的主要杂质为_____________,要进一步提纯,下列操
作中必须的是_______(填入正确选项前的字母):
A.重结晶 B.过滤 C.蒸馏 D.萃取
查看习题详情和答案>>