摘要:9. 混合两种未知物的溶液.生成1.25g沉淀.这个沉淀是二价金属盐.在1000℃灼烧.使沉淀完全分解.得到质量为0.70g的固体金属氧化物和另一种使石灰水变浑浊的无刺激性气味的气体.蒸发滤除沉淀后的溶液.得到2.0g干燥残渣.在200℃时慢慢加热残渣.使它分解仅得到两种产物:一种是气态氧化物.标况下的体积为0.56L.另一种是水.为0.90g.试确定未知物是什么.并写出有关推理.计算过程及化学方程式. 分析:能使石灰水变浑浊且无刺激性气味的气体应是CO2.故1.25g沉淀应为碳酸盐. 设碳酸盐的分子式为MCO3 此二价金属为Ca. 滤液蒸干后得2.0g残渣.受热分解为0.90g水和0.56L气态氧化物. 此气态氧化物的mol尔质量为: 分解产物的mol尔比: H2O∶RxOy∶0.05∶0.0252∶1 分解产物为H2O和气态氧化物.分解温度为200℃.故此盐为铵盐.并不可能是碳酸铵或碳酸氢按 此盐只能是NH4NO3 设其分解产物为H2O和NxOy 则对NxOy而言有 则 讨论.均为正整数.且只可能是1或2. (1)若 (2)若 由此可肯定此盐为NH4NO3.热分解产物为H2O和N2O. 未知物是
网址:http://m.1010jiajiao.com/timu_id_4383032[举报]
现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
|
阳离子 |
H+、NH4+、Mg2+、Ba2+、Al3+ |
|
阴离子 |
OH-、Cl-、HCO3-、NO3-、SO42- |
已知:①0.1 mol/L A溶液的pH <1;②将B溶液分别与其它四种溶液混合,均有白色沉淀生成;
③C溶液 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:
(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液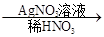 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。
(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
|
实验步骤 |
预期现象和结论 |
|
取适量C的溶液于试管中, ① 。 |
预期现象和结论1: ② ; 预期现象和结论2: ③ ; |
查看习题详情和答案>>