网址:http://m.1010jiajiao.com/timu_id_4383015[举报]
C6H5CHO+(CH3CO)2O?C6H5CH=CHCOOH+CH3COOH
有关数据如下表:
| 物质 | (CH3CO)2O | C6H5CHO | C6H5CH=CHCOOH | CH3COOH |
| 沸点 | 139℃ | 179℃ | 300℃ | 117.9℃ |
①在250mL三颈烧瓶中,加入7g无水K2CO3,5mL苯甲醛和14mL醋酸酐,电热套加热(或用油浴加热)回流45min(如图一,冷凝管可不通冷凝水).
②稍冷后,加入20mL水,缓慢加入适量固体碳酸钠,使溶液呈微碱性.进行水蒸气蒸馏(如图二),直到无油状物蒸出为止.
③水蒸气蒸馏残留液加入少量活性炭,煮沸数分钟趁热过滤,在搅拌下往热滤液中加入浓盐酸至呈酸性.
④冷却,过滤,用少量冷水洗涤产物,产物在空气中晾干,称重,计算产率.

回答下列问题:
(1)在肉桂酸的制备中,水蒸气蒸馏的目的是
(2)在肉桂酸制备实验中,为什么要缓慢加入固体碳酸钠来调节pH值?
(3)用少量冷水洗涤产物的目的:
(4)在浓强碱存在下,C6H5CHO发生反应:2C6H5CHO+KOH(浓)→C6H5COOK+C6H5CH2OH反应类型为:
(5)写出苯甲醛和丙酸酐[(CH3CH2CO)2O]在无水K2CO3存在下,发生的反应的化学方程式:


 用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:
用中和滴定法测定某烧碱的浓度.请回答主要操作过程中的有关问题:(1)配制待测溶液:将1.70g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液,所需的主要仪器除天平、药匙、200mL容量瓶、玻璃棒、烧杯外,还有
(2)滴定:①盛装0.20mol/L的盐酸标准溶液应该用
②滴定时,锥形瓶中加2-3滴酚酞作为指示剂,滴定过程中,一只手控制滴定管活塞,另一只手摇动锥形瓶,眼睛应注视锥形瓶内颜色变化和液滴流流速,当
③有关数据纪录如下:
| 滴定序号 | 待测溶液体积(单位:mL) | 所消耗盐酸体积(单位:mL) | ||
| 滴定前读数 | 滴定后读数 | 消耗盐酸体积 | ||
| 1 | 20.00 | 0.50 | 20.60 | V |
| 2 | 20.00 | 6.10 | 26.00 | |
(3)计算:烧碱样品的纯度为
(4)若该学生测定值偏大了,则该同学引起测定误差的可能原因是
A.酸式滴定管用水洗后,未用标准酸液润洗
B.酸式滴定管尖嘴部分有气泡未排除,滴定后气泡消失
C.锥形瓶用蒸馏水洗后,未用碱液洗
D.酸式滴定管起始读数俯视,滴定后读数仰视
E.在滴定过程中向锥形瓶中添加少量蒸馏水
F.取待测液时,碱式滴定管未用碱液洗
G.当锥形瓶中溶液局部变色时,停止滴定.
某实验小组欲制取苯甲酸乙酯(沸点213℃),主要实验仪器有:圆底烧瓶、分水器(如下图)、冷凝管,其他夹持装 置及胶塞等略。
置及胶塞等略。
![]() 实验步骤如下:
实验步骤如下:
![]() I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
I.取100ml圆底烧瓶,向其中分别加入以下三组试剂:①12.2g苯甲酸(其沸点为122℃,,相对分子质量为122)和2粒沸石②8ml(足量)无水乙醇 ③适量的浓硫酸
![]() II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
II. 如图所示连接实验装置,加热圆底烧瓶中的混合液,使反应产生的水蒸气经冷凝管冷凝回流到分水器中,通过分水器分离出来,用锥形瓶承接收集产生的水。
![]() III. 当不再有水生成,停止加热。
III. 当不再有水生成,停止加热。
![]() IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
IV. 冷却后,用饱和碳酸钠水溶液洗涤圆底烧瓶中的混合液并分液。
![]() V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
V. 取上层(有机层)混合液减压蒸馏,得到较为纯净的苯甲酸乙酯。
![]() 根据以上操作过程回答以下问题:
根据以上操作过程回答以下问题:
![]() (1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
(1)反应过程中浓硫酸有提高苯甲酸乙酯产率的作用,其原理为
![]() (2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
(2)用冷凝管冷凝时,冷水应该从 口进入,从 口流出;(填“上”或“下”)
![]() (3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
(3)操作步骤IV中,用饱和碳酸钠溶液洗涤反应后的混合液目的是
①洗去反应剩余的苯甲酸 ②洗去反应混合液中的乙醇
③降低苯甲酸乙酯的溶解度,有利于析出、分层,便于下一步的分液
④有利于苯甲酸乙酯的水解
(4)写出该反应的化学方程式
(5)实验过程中,如果温度过高会发生副反应,产生一种能使溴的四氯化碳溶液褪色的
无色稍有气味的气体,该气体的结构简式为
(6)实验结束收集分水器分离出的水,并测得质量为1.44g,计算苯甲酸乙酯的产率为 。实验中苯甲酸乙酯的实际产率总是小于此计算值,其原因可能是
①加热过程中乙醇挥发,冷凝后滴入分水器中,随冷凝的水一起被分出
②实验过程中,发生了副反应
③苯甲酸乙酯洗涤、蒸发过程中有损失。
查看习题详情和答案>>
现有一份含有FeCl3和FeCl2固体的混合物,为测定各成分的含量进行如下两个实验:
实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.22g
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4g
根据实验回答下列问题:
(l)溶解过程中所用到的玻璃仪器有_____________________。
(2)实验室保存FeCl2溶液时通常会向其中加入少量试剂_________和_________。
(3)实验2中通入足量Cl2的目的是____________________________________。
涉及的化学反应的离子方程式是____________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法
_______________________________________________________________
_______________________________________________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)______________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是_____________(填写序号字母)。
A. 胶体粒子能透过滤纸,但不能透过半透膜
B. 胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C. 只有胶体粒子能作布朗运动
D. 向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E. 在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为_________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
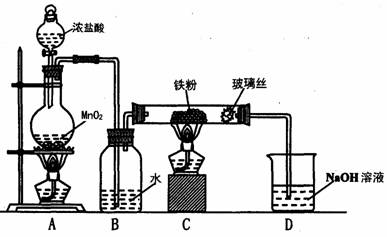
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_______________________________________________________________。
查看习题详情和答案>>实验1
①称取一定质量的样品,将样品溶解
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀
③将沉淀过滤、洗涤、干燥得到白色固体17.
实验2
①称取与实验1中相同质量的样品,将样品溶解
②向溶解后的溶液中,通入足量的Cl2
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________________________________________________。
(2)实验室保存。FeCl2溶液时通常会向其中加入少量试剂______________和_____________。
(3)实验2中通人足量Cl2的目的是__________________________________________________。
涉及的化学反应的离子方程式是___________________________________________________。
(4)简述检验实验2的步骤④中沉淀已经洗涤干净的方法_______________________________。
(5)加热FeCl3溶液,并将溶液蒸干时,通常不能得到FeCl3固体,请以平衡的观点解释其原因(方程式与文字相结合来说明)___________________________________________________。
(6)FeCl3溶液可以用于止血,主要是因为FeCl3溶液能使血液聚沉,这涉及到胶体的性质。以下关于胶体的说法不正确的是___________(填写序号字母)。
A.胶体粒子能透过滤纸,但不能透过半透膜
B.胶体粒子具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.只有胶体粒子能做布朗运动
D.向Fe(OH)3胶体中滴加硫酸,会先出现红褐色沉淀,随后沉淀消失
E.在蛋白质溶液中加入稀的CuSO4溶液,可使蛋白质盐析
(7)通过实验所得数据,计算得固体样品中FeCl3和FeCl2的物质的量之比为____________。
(8)实验室可以采用下列装置制取少量的FeCl3固体,已知FeCl3固体易潮解。(部分夹持仪器已略去)
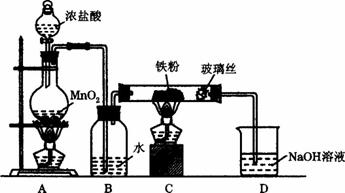
该装置存在不足,往往无法得到FeCl3固体,请你对该装置提出合理的改进措施
_____________________________________________________________________。
查看习题详情和答案>>