摘要:5.简单配合物 概念 表示 条件 共用电子对由一个原子单方向提供给另一原子共用所形成的共价键. A B 电子对给予体 电子对接受体 其中一个原子必须提供孤对电子.另一原子必须能接受孤对电子的轨道.
网址:http://m.1010jiajiao.com/timu_id_4382991[举报]
生物体中有许多含过渡金属离子的蛋白,其中有些金属蛋白在一定条件下能够吸收、释放氧气以供机体生命活动之需。这些天然载氧体的结构较复杂。研究发现,某些简单配合物也具有类似的载氧性质,可用作载氧体的模型化合物。研究较多的是钴(II)配合物。制备模型化合物的方法如下:水杨酸(邻羟基苯甲醛)和乙二胺在95%的乙醇溶液中反应,生成黄色晶体人通入氮气,加热,待黄色晶体溶解后,缓慢地加入醋酸钴,生成棕色沉淀。继续加热并搅拌,沉淀全部转变为暗红色B后,冷至室温,撤去氮气,滤出结晶,干燥之B是二聚体,在室温下稳定,不吸收氧气。但B在某些溶剂中可与溶剂L(如DMF或Py等)配位,并迅速吸收氧气形成暗黑色的分子氧加合物C。C在氯仿或苯中有细微气泡放出,并转变为暗红色。载氧试验结果: 360 mg样品B 在 15℃, 102.9kPa及饱和水蒸气压 1.2 kPa下,吸收 O2(设为理想气体) 12.90cm3。
3-1.写出A的化学式。
3-2.计算载氧试验中,Co 与被吸收氧气的物质的量之比。
3-3.画出C的结构示意图。
3-4.写出C在氯仿中的反应方程式。
查看习题详情和答案>>(2011?咸阳模拟)【化学--选修物质结构与性质】
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
(1)写出B原子的基态电子排布式
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点
(4)A、B两元素第一电离能
(5)C元素的原子能形成多种配合物.形成配合物的条件是:一方能够提供孤对电子,另一方
查看习题详情和答案>>
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
| 元素 | A | B | C | D |
| 性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104s2 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
1s22s22p63s23p4
1s22s22p63s23p4
.(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点
高
高
(填“高”或“低”),其原因是因为A的氢化物分子间存在氢键
因为A的氢化物分子间存在氢键
.(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点
低
低
(填“高”或“低”);D元素在形成最简单氢化物时所采取的杂化类型是SP3
SP3
.(4)A、B两元素第一电离能
N
N
>O
O
.(填元素符号)(5)C元素的原子能形成多种配合物.形成配合物的条件是:一方能够提供孤对电子,另一方
能够提供(接受孤对电子的)空轨道
能够提供(接受孤对电子的)空轨道
.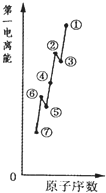 物质结构的多样性让人类使用的材料精彩纷呈.
物质结构的多样性让人类使用的材料精彩纷呈.(1)如图是原子序数相连的七种短周期元素第一电离能示意图.其中硼B元素是
(2)乙二酸俗名草酸,是最简单的有机二元酸之一,结构简式为
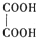 ,草酸钠晶体中存在
,草酸钠晶体中存在A.金属键B.非极性键 C.键D.范德华力 E.氢键 F.离子键
(3)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用.锆石与钛同族的第五周期元素,锆原子的价电子排布式为
(4)含氧酸可电离的氢原子来自羟基,碳酸的结构式可表达为
(5)PtCl4和氨水反应可获得PtCl4?4NH3,PtCl4?4NH3是一种配合物.100mL0.1mol?L-1 PtCl4?4NH3溶液中滴加足量AgNO3溶液可产生2.87g白色沉淀.该配合物溶于水的电离方程式为
若元素原子的最外电子层只有一个电子,该电子的电子层数n=4.请回答下列问题:
(1)符合上述条件的元素共有 种.
(2)在符合上述条件的元素中,原子序数最小的在周期表的 区(用符号填空),原子序数最大的在周期表的第 周期、 族.
(3)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+ 颜色(填“无”或“有”).
(4)符合上述条件的元素中,原子序数最大、且与水分子形成的配合物有颜色的简单离子的符号为 .
查看习题详情和答案>>
(1)符合上述条件的元素共有
(2)在符合上述条件的元素中,原子序数最小的在周期表的
(3)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+
(4)符合上述条件的元素中,原子序数最大、且与水分子形成的配合物有颜色的简单离子的符号为
B.铁强化酱油是在酱油添加食品强化剂--乙二胺四乙酸铁钠盐,乙二胺四乙酸铁钠盐化学式为:C10H12FeN2NaO8?3H2O,式量:421,EDTA铁钠盐呈浅土黄色结晶粉末,性稳定,易溶于水及难溶于乙醇.1%的水溶液pH约为3.5,可由乙二胺四乙酸一钠盐(NaH3EDTA)与氯化铁制取,制取原理如下:

实验室制备NaFeEDTA?3H2O步骤如下:
①把0.4g(0.01mol)NaOH溶于10mL蒸馏水,然后再加入3.8g(0.01mol)Na2H2EDTA?2H2O,把溶液微热,直至固体完全溶解.
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3?6H2O.称取2.5g(0.009mol)FeCl3?6H2O溶于5mL,蒸馏水中(并加1滴盐酸).
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出.
⑤冷却、采用右图装置减压过滤,先用冰水洗涤再用乙醇洗涤.
⑥将固体凉干,称得制得的淡黄色粉末2.8g.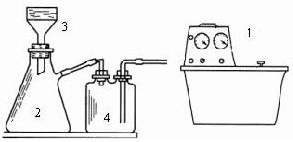
试回答下列问题
(1)在步骤①中,不能加入过量的碱,是因为 .
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是 ;加显色剂后分别发生反应的离子方程式为 ; .
(3)步骤⑤中用冰水和乙醇洗涤的目的是, , .
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是: .
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是 (写化学式).
(6)本次实验的NaFeEDTA?3H2O的实际产率为: .
查看习题详情和答案>>

实验室制备NaFeEDTA?3H2O步骤如下:
①把0.4g(0.01mol)NaOH溶于10mL蒸馏水,然后再加入3.8g(0.01mol)Na2H2EDTA?2H2O,把溶液微热,直至固体完全溶解.
②用含有氯化铜杂质的氯化铁提纯并制得FeCl3?6H2O.称取2.5g(0.009mol)FeCl3?6H2O溶于5mL,蒸馏水中(并加1滴盐酸).
③将①、②制得的两溶液混合
④加热溶液至沸腾,蒸发浓缩直至大部分粉末状的固体析出.
⑤冷却、采用右图装置减压过滤,先用冰水洗涤再用乙醇洗涤.
⑥将固体凉干,称得制得的淡黄色粉末2.8g.

试回答下列问题
(1)在步骤①中,不能加入过量的碱,是因为
(2)将含有氯化铜杂质的氯化铁溶液分离可用的简单方法是
(3)步骤⑤中用冰水和乙醇洗涤的目的是,
(4)本实验得到的是粉末状淡黄色的粉末,没有得到块状的晶体,可能的原因是:
(5)检验某品牌酱油中是否加有NaFeEDTA?3H2O,先取20mL酱油加入10mL75%乙醇,将所得沉淀物溶于水,并用某盐酸调到pH<0.5,破坏配合物,然后加入某种铵盐检验,该铵盐是
(6)本次实验的NaFeEDTA?3H2O的实际产率为: