摘要:1.键的极性和分子的极性 分子 共价键的极性 分子中正负 电荷中心 结论 举例 同核双原子分子 非极性键 重合 非极性分子 H2.N2.O2 异核双原子分子 极性键 不重合 极性分子 CO.HF.HCl 异核多原子分子 分子中各键的向量和为零 重合 非极性分子 CO2.BF3.CH4 分子中各键的向量和不为零 不重合 极性分子 H2O.NH3.CH3Cl
网址:http://m.1010jiajiao.com/timu_id_4382987[举报]
关于共价键的极性和分子的极性的描述正确的是( )
A.键的极性越强,分子的极性就越强
B.HBr分子中共价键的极性比HI的分子中的共价键的极性强,所以HBr的熔沸点比HI的熔沸点高
C.极性分子中一定含有极性共价键
D.极性分子中一定不含非极性共价键
查看习题详情和答案>>
膦(分子式为PH3)在常温下呈气态,有大蒜气味,有毒,是电石气中所含杂质之一,其分子构型为三角锥形.下列有关PH3的叙述错误的是
- A.PH3分子中的化学键为极性共价键
- B.PH3是非极性分子
- C.PH3能和盐酸反应生成一种盐
- D.PH3的沸点比NH3的低
下列分子结构图中的 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键
表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键
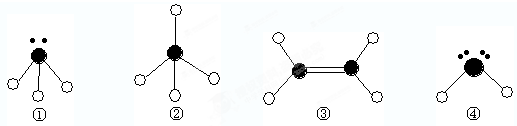
(1)以上分子中,中心原子采用sp2杂化的是
(2)在③的分子中有
(3)4种分子中,属于极性分子的是
(4)已知液态①和④相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则①的电离方程式为:
查看习题详情和答案>>
 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键
表示短周期的相邻的三种元素原子.小黑点表示没有形成共价键的最外层电子,短线表示共价键
(1)以上分子中,中心原子采用sp2杂化的是
C2H4
C2H4
(填化学式);(2)在③的分子中有
5
5
个σ键.在③与溴的四氯化碳溶液反应中,断裂的是③分子中的π
π
键(填“σ”或“π”),形成的是δ
δ
键(填“σ”或“π”).(3)4种分子中,属于极性分子的是
①④
①④
(填序号,下同).键角由大到小的顺序是③②①④
③②①④
,能结合质子(即H+)形成稳定离子的是①④
①④
,形成配位
配位
键(按电子对提供方式分类).(4)已知液态①和④相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则①的电离方程式为:
2NH3?NH4++NH2-
2NH3?NH4++NH2-
. 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。