网址:http://m.1010jiajiao.com/timu_id_4375603[举报]
(14分)在化学反应中,只要物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:2Na+C12 =2NaCl,反应前后,Na元素、Cl元素的化合价分别发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应(部分反应条件略去)属于氧化还原反应的是
(填写序号);
①C+O2 == CO2 ②CaO+H2O==Ca(OH)2 ③CaCO3==CaO+CO2↑
④2H2O2 == 2H2O+O2↑ ⑤CO+CuO=Cu+CO2 ⑥HCl+NaOH=NaCl+H2O
(2) 含有高价态元素的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
①该反应的化学方程式可表示为 ;
②向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是
(写化学式,下同),滤液中的溶质是 。
(3) 通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中其元素化合价升高总数 (填“大于”、“等于”或“小于”)化合价降低升高总数。氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是_______。 (写化学式)
(4)柠檬果汁中含有维生素C(C6H8O6,简写成Vc)是还原剂,它能被I2氧化生成C6H6O6。当前市场上测定柠檬果汁中Vc含量的方法是取10.00mL果汁,用醋酸酸化,再加入20.00mL 0.02500 mol?dm-3标准碘溶液,然后以淀粉溶液作指示剂,最后用0.01000 mol?dm-3Na2S2O3标准溶液滴定过量的I2,消耗Na2S2O3溶液10.00mL。
①Vc中碳元素的平均化合价是 。
②写出Vc与I2反应的离子方程式。
③此份果汁中含Vc= mg/100mL果汁。
查看习题详情和答案>>
SO2随意排放会造成严重的大气污染.下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法.
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
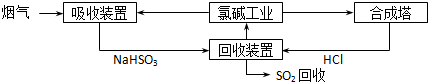
①“吸收装置”中发生反应的离子方程式是______;
②合成塔中每合成1mol 气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是______;
③上述流程中循环利用的物质是______.
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2.
①该反应的离子方程式是______(反应a).为验证该反应,同学们将SO2通入0.05mol?L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色.关于红褐色液体,以下是同学们的分析推测与实验.
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 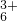 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是______(用离子方程式及必要的文字说明);
④经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO2通入FeCl3溶液中产生上述现象的原因是______. 查看习题详情和答案>>
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
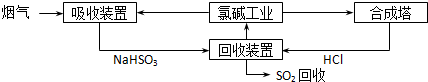
①“吸收装置”中发生反应的离子方程式是______;
②合成塔中每合成1mol 气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是______;
③上述流程中循环利用的物质是______.
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2.
①该反应的离子方程式是______(反应a).为验证该反应,同学们将SO2通入0.05mol?L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色.关于红褐色液体,以下是同学们的分析推测与实验.
| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是______(用离子方程式及必要的文字说明);
④经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO2通入FeCl3溶液中产生上述现象的原因是______.
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
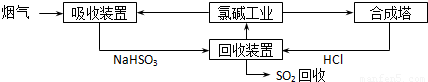
①“吸收装置”中发生反应的离子方程式是______;
②合成塔中每合成1mol 气体放出热量92.3kJ(25℃、101kPa),反应的热化学方程式是______;
③上述流程中循环利用的物质是______.
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2.
①该反应的离子方程式是______(反应a).为验证该反应,同学们将SO2通入0.05mol?L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色.关于红褐色液体,以下是同学们的分析推测与实验.
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 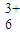 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是______(用离子方程式及必要的文字说明);
④经讨论后得出结论:FeCl3溶液和SO2反应过程中,反应a、b在体系中共存.请从化学反应速率和反应限度的角度分析,SO2通入FeCl3溶液中产生上述现象的原因是______.
查看习题详情和答案>>
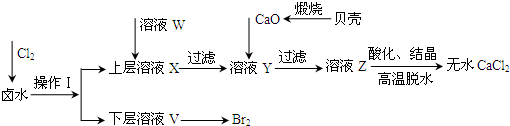
(1)操作Ⅰ使用的试剂是
(2)加入溶液W的目的是
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol?L-1 |
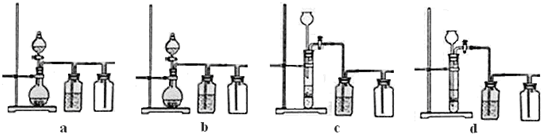
(4)常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-8;H2CO3的电离常数Ka1=4.5×10-7,Ka2=4.7×10-11.某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测量溶液的pH,若前者的pH小于后者,则H2SO3酸性强于H2CO3.该实验设计不正确,错误在于
设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论).
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
方案一:配制相同物质的量浓度的NaHSO3和NaHCO3溶液.用酸度计(或pH试纸)测两溶液的pH.前者的pH小于后者,证明H2SO3酸性强于H2CO3.
方案二:将SO2气体依次通过NaHCO3(或Na2CO3)溶液、酸性KMnO4溶液、品红溶液、澄清石灰水.品红溶液不褪色,且澄清石灰水变浑浊,证明H2SO3酸性强于H2CO3.
方案三:将CO2气体依次通过NaHSO3(或Na2SO3)溶液、品红溶液.品红溶液不褪色,证明H2SO3酸性强于H2CO3
仪器自选.
供选择的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸.