网址:http://m.1010jiajiao.com/timu_id_4373415[举报]
(1)H2O2的电子式是


(2)将双氧水加入经酸化的KMnO4溶液中,溶液的紫红色消褪了,此时双氧水表现出
(3)实验室用双氧水制取氧气时常加入二氧化锰,该反应的化学方程式为
| ||
| ||
(4)过氧化氢具有漂白性.某学生研究了过氧化钠跟水的反应,实验过程如下:向盛有少量过氧化钠固体的试管中滴加水,直到气体不再放出,再加水稀释所得溶液.将得到的溶液平均分成两份盛放在两支试管中,进行下列实验:
实验一:一支试管中滴加酚酞试液,溶液变红,半分钟内红色褪去;
实验二:另一支试管中加入少量二氧化锰,又有气体放出,待气体不再放出,再滴加酚酞,溶液变红,持久不褪色.请回答下列问题:
①实验一酚酞变红后,半分钟内红色又褪去,原因
②H2O2常被称作“绿色氧化剂”的原因是
③我们知道,稀硫酸与铜不反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式
《物质结构与性质》模块试题
1.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出元素o的基态原子电子排布式 ① 。
(2)d的氢化物的分子构型为 ② ,中心原子的杂化形式为 ③ ;k在空气中燃烧产物的分子构型为 ④ ,中心原子的杂化形式为 ⑤ ,该分子是 ⑥ (填“极性”或“非极性”)分子。
(3)第三周期8种元素按单质熔点高低的顺序如下图,其中序号“8”代表 ⑦ (填元素符号);其中电负性最大的是 ⑧ (填下图中的序号)。

(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 ⑨ ,试从结构角度加以解释: ⑩ 。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为![]() ,一个晶胞中i原子的数目为
,一个晶胞中i原子的数目为![]() 。
。
②该晶体的密度为![]() (用字母表示)。
(用字母表示)。
2.有A、B、C、D、E、F、G七种元素,除E为第四周期元素外其余均为短周期元素。A、E、G位于元素周期表的s区,其余元素位于p区,A、E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的第一电离能列同周期主族元素第三高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:
(1)写出下列元素的符号:D ① ,G ② 。
(2)D的前一元素第一电离能高于D的原因: ③ 。
(3)由A、B、C形成的ABC分子中,含有 ④ 个σ键, ⑤ 个π键。
(3)由D、E、F、G形成的盐E2DF4、GDF4的共熔体在冷却时首先析出的物质是 ⑥ (写化学式),原因是 ⑦ 。
《有机化学基础》模块试题
3.M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,在战争中保住了很多士兵的生命,M5纤维是线型结构且又有分子间氢键的聚合物,在三维方向x、y、z上,当方向z是聚合物主链方向时,在x方向和y方向上的氢键是其晶体结构的特征。下面是M5纤维的合成路线(部分反应未注明条件):

请回答:
(1)合成M5的单体的结构简式:F ① ,G ② 。
(2)反应类型:A![]() B: ③ ,B
B: ③ ,B![]() C: ④ 。
C: ④ 。
(3)生成A的同时可能生成的A的同分异构体: ⑤ 。
(4)写出化学反应方程式:C![]() 对苯二甲酸: ⑥ ;D
对苯二甲酸: ⑥ ;D![]() E: ⑦ 。
E: ⑦ 。
(5)1 mol的F与NaHCO3溶液反应,最多耗NaHCO3 ⑧ mol。
(6)M5纤维分子间为什么会有氢键?请分析说明: ⑨ 。
4.现有A、B、C、D四种有机物,已知:它们的相对分子质量都是104;A是芳香烃,B、C、D均为烃的含氧衍生物,四种物质分子内均没有甲基;A、B、C、D能发生如下反应生成高分子化合物X、Y、Z(反应方程式未注明条件):
①nA![]() X ②nB
X ②nB![]() Y(聚酯)+nH2O ③nC+nD
Y(聚酯)+nH2O ③nC+nD![]() Z(聚酯)+2nH2O
Z(聚酯)+2nH2O
请按要求填空:
(1)A的结构简式是 ① ,Z的结构简式是 ② 。
(2)在A中加入少量溴水并振荡,所发生反应的化学方程式: ③ 。
(3)B的同分异构体有多种,其中分子中含结构![]() 的同分异构体的结构简式分别是 ④ 。
的同分异构体的结构简式分别是 ④ 。
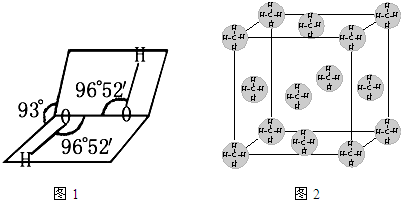
(1)H、O、S电负性由大到小的顺序是
(2)如图1是H2O2的空间构型,H2O2中每个氧都是
(3)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)甲烷晶体的晶胞如图2所示,此晶体在常温、常压下不能存在的原因
A.《物质结构与性质》模块(12分)
二茂铁【(C5H5)2 Fe】是由一个二价铁离子和2个环戊烯基负离子构成,它的发现可以说是有机金属化合物研究中具有里程碑意义的事件,它开辟了金属有机化合物研究的新领域,促进了金属有机化学的发展。二茂铁可以用还原铁粉与环戊二烯在氮气氛围中发生反应而制得:
2C5H6+Fe(还原铁粉)![]() (C5H5)2 Fe+H2。
(C5H5)2 Fe+H2。
请回答下列问题:
(1)写出二价铁离子的基态电子排布式: ;
(2)二茂铁的熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。据此可推断二茂铁晶体为 晶体,由此可进一步推知,在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是 ;
(3)环戊二烯的结构式为: (图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),
(图中数字仅代表碳原子编号),在其5个碳原子中采取sp3杂化的是 (填写编号),![]() 是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
是环茂二烯的一种同分异构体,在其分子结构中处于同一平面上的原子个数最多有 个;
(4)原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与N2分子互为等电子体的二价阴离子是 (填化学式),其电子式是 。
B.《实验化学》模块(12分)
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,在教师指导下设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是: 。
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为佳,加入 (填化学式)试剂可达这一目的。
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”)。
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN
(填“>”或“<”)。
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
查看习题详情和答案>>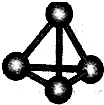 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.请回答下列问题(填空时用实际符号):
(1)C的元素符号是
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为
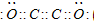
(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示,已知断裂1molC-C吸收167kJ热量,生成1molC=C放出942kJ热量.根据以上信息和数据,下列说法正确的是
①C4属于一种新型的化合物
②C4沸点比P4(白磷)低
③lmol C4气体转变为C2吸收882kJ热量
④C4与C2互为同素异形体
⑤C4稳定性比P4(白磷)差
⑥C4属于原子晶体
⑦C4和P4 (白磷)的晶体都属于分子晶体
⑧C4与C2互为同分异构体
(4)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为
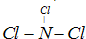
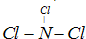
(5)为了除去化合物乙(A2ED4)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似.对此以下说法正确的是
a.E2F2的结构式为:F-E-E-F
b.E2F2为含有极性键 和非极性键的非极性分子
c.E2Br2与E2F2结构相似,熔沸点:E2Br2>E2F2
d.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+3E↓+4HF
(7)举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):