摘要: 外因对平衡移动的影响 (1)浓度: 增大反应物浓度或减少生成物浓度, 平衡 移动, 减少反应物浓度或增大生成物浓度, 平衡 移动. (2)温度: 升温,平衡向 方向移动, 降温,平衡向 方向移动. (3)压强: 对于有气体参加的可逆反应.加压,平衡向气体体积 方向移动, 减压,平衡向气体体积 方向移动. (4)催化剂: 对化学平衡 ,但能缩短到达平衡所需的时间. [总结]勒夏持列原理: [例1]以2A △H<0为例,画出平衡条件改变时的υ- t 图 .并思考在下列条件下A的转化率.C%和混合气体的平均摩尔质量如何变化? ① 增大c(A) ③降温 ② 增大P ④使用催化剂 [例2]( )已知反应A2(g)+2B2(g)2AB2(g)的△H<0.下列说法正确的是 A. 升高温度.正向反应速率增加.逆向反应速率减小 B. 升高温度有利于反应速率增加.从而缩短达到平衡的时间 C. 达到平衡后.升高温度或增大压强都有利于该反应平衡正向移动 D. 达到平衡后.降低温度或减小压强都有利于该反应平衡正向移动 [巩固练习]
网址:http://m.1010jiajiao.com/timu_id_4370053[举报]
卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2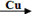 NF3+ 3NH4F
NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)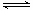 TaS2(s)+2I2(g)+Q kJ,Q>0
TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
| A.平衡常数K增大 | B.S2的浓度减小 | C.I2的质量减小 | D.V(TaI4)逆 增大 |
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____________(填增大或减小),其原因是________________________ 。 查看习题详情和答案>>
 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体.
请回答:
(1)A中的现象
气体颜色加深
气体颜色加深
,B中的现象气体颜色变浅
气体颜色变浅
;(2)由此可知,降低温度,该化学平衡向
正
正
(填“正”或“逆”)反应方向移动;(3)该化学反应的浓度平衡常数表达式为
Kc=
| [N2O4] |
| [NO2]2 |
Kc=
,升高温度,该反应中NO2的转化率将| [N2O4] |
| [NO2]2 |
减小
减小
(填“增大”、“减小”或“不变”).Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭.
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深.
①推进针筒后颜色变深的原因是
气体的体积减小,NO2浓度增大,气体的颜色加深
气体的体积减小,NO2浓度增大,气体的颜色加深
;②一段时间后气体颜色又变浅的原因是
增大压强,减小气体的体积,平衡向正反应方向移动
增大压强,减小气体的体积,平衡向正反应方向移动
;③由此实验得出的结论是
增大压强,化学平衡向气态物质系数减小的方向移动
增大压强,化学平衡向气态物质系数减小的方向移动
.(2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是
气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅
气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅
;在此过程中,该反应的化学平衡常数将不变
不变
(填“增大”、“减小”或“不变”,下同),NO2的转化率将减小
减小
.