摘要:3.晶体结构与性质--物理性质 (1)晶体类型及其性质 离子晶体 分子晶体 原子晶体 金属晶体 组成微粒 阴.阳离子 分子 原子 金属离子和自由电子 微粒间的相互作用 离子键 分子间作用力 共价键 金属键 是否存在单个分子 不存在 存在 不存在 不存在 熔.沸点 较高 低 很高 高低悬殊 硬度 较大 小 很大 大小悬殊 导电情况 晶体不导电. 溶于水或熔融状态下导电 晶体或熔融状态下不导电. 溶于水时部分晶体能导电 晶体为半导体或绝缘体 晶体导电 (2)晶体熔.沸点高低的比较 一般规律:原子晶体>离子晶体>分子晶体. ① 离子晶体:离子晶体的晶格能越大.则离子键越强.晶体熔.沸点越高. 晶格能比较:阴.阳离子所带电荷越多.半径越小.则晶格能越大. 例如:MgO>NaCl(Mg2+半径小.所带电荷多). FeO>NaCl(Fe2+与Cl–电子层数相同.O2–与Na+电子层数相同.但FeO中离子所带电荷数多) ② 分子晶体:组成和结构相似的分子晶体.相对分子质量越大.分子间作用力越强.晶体的熔.沸点越高. 例如:F2<Cl2<Br2<I2. 此外.当分子形成分子间氢键时.分子晶体的熔.沸点升高. 例如:NH3.H2O.HF的熔.沸点均比同主族下一周期的氢化物来的高. ③ 原子晶体:原子半径越小.键长越短.键能越大.键越牢固.晶体的熔.沸点越高. 例如:金刚石>二氧化硅>金刚砂>晶体硅. ④ 金属晶体:金属离子所带电荷越多.半径越小.金属键越强.晶体的熔.沸点越高. 例如:Na<Mg<Al. (3)晶体化学式的确定 ① 分子结构:分子结构中每一个微粒均属于该分子.按结构中的微粒数书写的式子即为其化学式. ② 晶体结构 分摊法:按晶体结构中各微粒对结构单元的贡献计算出的微粒数目的最简整数比书写的式子即为其化学式. 紧邻法:按晶体结构中各微粒周围与之距离最近且相等的另一微粒数目的最简整数比书写的式子即为其化学式. (4)金属晶体 ① 金属的导电性.导热性和延展性均与自由电子有关. ② 金属晶体的堆积方式 六方堆积:配位数为12,面心立方堆积:配位数为12, 体心立方堆积:配位数为8.
网址:http://m.1010jiajiao.com/timu_id_4367290[举报]
[物质结构与性质](15分)
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① | | | | | | | | | | | | | | | | | |
| | ② | | | | | | | | | | | | ③ | ④ | ⑤ | ⑥ | |
| | ⑦ | | | | | | | | | | | | | | | ⑧ | |
| | | | | | ⑨ | | | | | ⑩ | | | | | | | |
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是_______。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。
 查看习题详情和答案>>
查看习题详情和答案>>
 《物质结构与性质》
《物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是
A
A
(填字母).A.元素电负性由大到小的顺序为F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Br>Se>As
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
O=C=S
O=C=S
.光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为平面三角形
平面三角形
(用文字描述).(3)Cu 2+基态的电子排布式为
1s22s22p63s23p63d9
1s22s22p63s23p63d9
.向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为sp3
sp3
,不考虑空间构型,其内界结构可用示意图表示为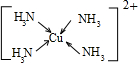

(物质结构与性质)化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素的最外层中P轨道上的电子数等于前一电子层电子总数,X原子最外层的P轨道中有一个轨道填充了2个电子。则
(1)X原子的电子排布式是 ,Y原子的价层电子轨道表示式是
(2)YX2的分子构型是 ,YX2的熔沸点比ZX2 ,(选填“高”或“低”),理由是
(3)YX2分子中,Y原子的杂化类型是 ,一个YX2分子中含 个![]() 键。
键。
(4)下图表示一些晶体的结构(晶胞),其中代表YX2的是

[化学-物质结构与性质]
硼元素B在化学中有很重要的地位.硼的化合物在农业、医院、玻璃等方面用途很广.请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式______,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为______.
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是______.
(3)在BF3分子中中心原子的杂化轨道类型是______,SiF4微粒的空间构型是______.
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.如图所示是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据图示确定硼化镁的化学式为______.
查看习题详情和答案>>
硼元素B在化学中有很重要的地位.硼的化合物在农业、医院、玻璃等方面用途很广.请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子分布式______,从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为______.
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是______.
(3)在BF3分子中中心原子的杂化轨道类型是______,SiF4微粒的空间构型是______.
(4)科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列.如图所示是该晶体微观窨中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据图示确定硼化镁的化学式为______.

[化学--物质结构与性质]
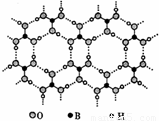
硼酸能够吸收中子,屏蔽核辐射.硼酸晶体具有层状结构,其每一层结构如图所示.
(1)硼酸晶体属于______(填“离子晶体”、“分子晶 体”或“原子晶体”),B元素的电负性______O元素(填“>”或“<”).
(2)硼酸晶体中,B的杂化轨道类型是______.
(3)硼酸晶体中,微粒间的作用力类型有______.
(4)硼酸是一元弱酸,其呈酸性的机理是:硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,导致溶液中c(H+)>c(OH-).Y-的结构简式是______;硼酸与水作用时,每生成一个Y-,断裂______个σ键.
(5)三氟化硼水解生成硼酸和氟硼酸(H[BF4]),BF4-的空间结构与CH4相似.BF4-和BF3中硼氟键的键长如表所示.
从表中数据可以看出,BF3中硼氟键的键长比BF4-的B-F键的键长短,原因可能是______.
 查看习题详情和答案>>
查看习题详情和答案>>
硼酸能够吸收中子,屏蔽核辐射.硼酸晶体具有层状结构,其每一层结构如图所示.
(1)硼酸晶体属于______(填“离子晶体”、“分子晶 体”或“原子晶体”),B元素的电负性______O元素(填“>”或“<”).
(2)硼酸晶体中,B的杂化轨道类型是______.
(3)硼酸晶体中,微粒间的作用力类型有______.
(4)硼酸是一元弱酸,其呈酸性的机理是:硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,导致溶液中c(H+)>c(OH-).Y-的结构简式是______;硼酸与水作用时,每生成一个Y-,断裂______个σ键.
(5)三氟化硼水解生成硼酸和氟硼酸(H[BF4]),BF4-的空间结构与CH4相似.BF4-和BF3中硼氟键的键长如表所示.
| BF4- | BF3 | |
| 键长/pm | 152 | 130 |
 查看习题详情和答案>>
查看习题详情和答案>>