网址:http://m.1010jiajiao.com/timu_id_4367272[举报]
反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
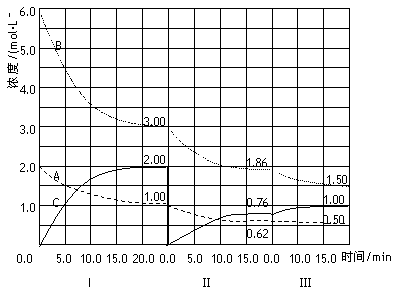
回答问题:
(1)反应的化学方程式中,a:b:c为_____________;
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为_________;
(3)B的平衡转化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是_____,其值是__________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是________________,采取的措施是____________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”)。
查看习题详情和答案>>反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其它反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其它反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答下列问题:
(1) 反应的化学方程式中,a:b:c为_____________;
(2) A的平均反应速率vI (A)、vⅡ (A)、vⅢ (A)从大到小排列次序为_________;
(3) 由第一次平衡到第二次平衡,平衡移动的方向是_________,采取的措施是________;
(4) 比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2 T3(填“>”“<”“=”),判断的理由是_________________________________________; Ks5u
查看习题详情和答案>> cC( g) (△H<0) 在等容条件下进行。改变其他反应条件,在 I、Ⅱ、Ⅲ阶段,体系中各物质浓度随时间变化的曲线如图所示。下列推断合理的是
cC( g) (△H<0) 在等容条件下进行。改变其他反应条件,在 I、Ⅱ、Ⅲ阶段,体系中各物质浓度随时间变化的曲线如图所示。下列推断合理的是 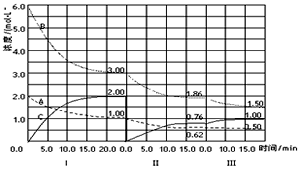
B.物质A的平均反应速率按从大到小的排列次序为vI(A)>vⅡ(A)>vⅢ(A)
C.在I、Ⅱ、Ⅲ三次平衡中,B的转化率最小的是aI(B)
D.第Ⅱ阶段的反应温度(T2)和第Ⅲ阶段的反应温度(T3)的大小关系为T2< T3
aA(g)+bB(g)![]() cC(g)+dD(g)反应达到平衡时,瞬时速率
cC(g)+dD(g)反应达到平衡时,瞬时速率![]() 为速率常数),又
为速率常数),又![]() 为化学平衡常数).在2L体系中加入4 mol SO2和2 mol O2且500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
为化学平衡常数).在2L体系中加入4 mol SO2和2 mol O2且500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
(1)起始时正反应速率是平衡时的_________倍.
(2)在500℃时该反应的平衡常数k2是_________.
(3)在温度不变时再向平衡体系中加入2 mol SO2、2 mol O2和4 mol SO3,平衡将向_________移动.
反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为________。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________。
(3)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是__________________________。
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低: T2________T3(填“>”、“=”、“<”),判断的理由是__________________________。
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
