摘要:高考第6题:考查离子共存 B选项HCO3-与AlO2-不能共存.因为水解AlO2-呈碱性. OH- 会与HCO3- 反应生成CO32- 和H2O, A选项加NaOH后不能产生沉淀,C选项加NaOH后不能产生气体. 选 D 高考第7题:考查盐溶液之间反应的计算. 用电荷守恒法求解.CO32-带负电荷总数与Mn2+带正电荷总数相等. 15×2×2=40×0.5×n 解之n=3 选B 高考第8题:考查化学方程式书写. 只有B选项没有配平. 高考第9题:考查有机物化学式的计算. 用相同基团法求解.因为乙酸的分子式为C2H4O2链状烯烃的通式为( CH2)n 所以混合物的通式可写为( CH2)nOm 当氧的质量分数为a时.CH2烃 的质量分数为1-a.则碳的质量分数为(1-a) ×12/14 选C 高考第10题:考查电解质溶液中微粒浓度的关系. 用电荷守恒法考虑.因为氨水和盐酸混合后有:C(.NH4+)+C(H+)=C(OH-)+C(Cl-) 所以'大加小"应等于'小加大".选C 高考第11题:考查依据方程式计算.用差量法求解.选A 高考第12题:考查有机物结构和性质的关系.抓住官能团和性质的关系.有什么官能团.就有什么性质.选D 高考第13题:考查化学平衡的概念.简单计算与图像.应抓住正反应放热.图像中第6分钟达到平衡且平衡时X的浓度变化量为0.85的特点.进行判断和计算.选B 高考第27题:考查CO2 .SO2.H2O蒸汽的检验.这是一道考生非常熟悉的常规题目.只要细心.肯定会答. 高考第28题:考查电解的规律.计算和有关问题.抓住C极质量增加.可知C上析出铜.则C为阴极.所以b为阳极.OH-失电子被氧化,M为负极.N为正极, 高考第29题:考查元素周期表.周期律.分子结构.物质推断.氢键.分子间作用力.方程式书写等知识.能力要求较高.题目综合性较强.是一道好题. 高考第30题:考查有机物之间的转化.以框图形式命题.是常见的形式.考生并不陌生.让回答的有分子式.命名.结构简式.反应类型.化学方程式.同分异构体.这些都是有机物平时练习的重点.也是有机框图题考查的热点. 点评三: 三道大题失分几率高 西安市第一中学高级教师 从厚润 [试卷综述]2009化学试题难度与2008年相比难度相当.选择题部分中等及以上程度的学生虽然能比较顺利地完成.但选择性计算题的比例大大地增多.这样学生答选择题用的时间就会长些.以至于答非选择题的时间就很紧张. 在化学的主观性试题中.强调了化学学科内的综合能力考查.对考生分析和解决问题的能力提出了更高要求.29题元素推断题涉及到砷(As)元素的化合物是现教材没有的内容;30题的有机题.同分异构体较复杂.要求学生写的较多.考了卤代烃的命名.这是现教材不要求学生掌握的.可以说.这几道题对中等以下学生而言.失分的几率很高. [亮点题型]27题是2002年广东高考化学试题的17题稍作改编而来的.是化学第Ⅱ卷中相对比较简单的试题.实验原理和实验装置来自教材内容.但高于教材.设问新颖.全面考查考生的实验设计能力. [贴近生活]30题通过存在于金橘中的一种香料考查相应的化学学科知识. [命题启示]一些历年考试中复现率非常高的精品题.在考试中依然出现.像离子共存.离子浓度大小判断.有机物官能团性质判断.化学反应速率和化学平衡计算.判断等等.
网址:http://m.1010jiajiao.com/timu_id_4357365[举报]
填写下列空白:
(1)周期表中最活泼的非金属元素是(写元素符号)
(2)第ⅣA族中,可用作半导体材料的元素是
(3)所含元素超过18种的周期是第
(4)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数
③F-、Na+、Mg2+、Al3+的离子半径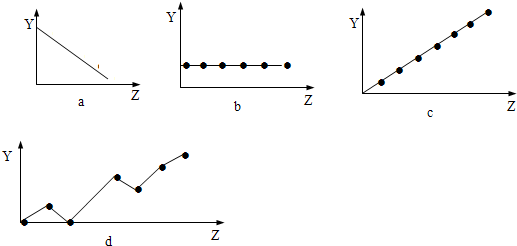
查看习题详情和答案>>
(1)周期表中最活泼的非金属元素是(写元素符号)
F
F
;位于第17
17
纵行.(2)第ⅣA族中,可用作半导体材料的元素是
Si、Ge
Si、Ge
(写元素符号).(3)所含元素超过18种的周期是第
6、7
6、7
周期.(4)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数
b
b
;②第3周期元素的最高化合价c
c
;③F-、Na+、Mg2+、Al3+的离子半径
a
a
.
在密闭容器内,使1mol N2 3mol H2混合发生下列反应:3H2+N2?2NH3 △H<0
(1)当反应达到平衡时,N2和H2的浓度比是
(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量
(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将
(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将
(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将
(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
查看习题详情和答案>>
(1)当反应达到平衡时,N2和H2的浓度比是
1:3
1:3
.(2)保持体积不变,升高温度时,混合气体的平均相对分子是质量
减少
减少
,密度不变
不变
.(填增大、减少或不变,第3~6题填“正向”、“逆向”或“不”)(3)当达到平衡时,充入Ar气,并保持体积不变,平衡将
不
不
移动.(4)当达到平衡时,充入Ar气,并保持压强不变,平衡将
逆向
逆向
移动.(5)当达到平衡时,充入NH3气,并保持压强不变,平衡将
逆向
逆向
移动.(6)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡将
正向
正向
移动.A、B、C、D、E、F、H、I、J有如图所示的转化关系.图1中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素.其它信息见下表:
(l)写出F的化学式 ,H的电子式 .
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 .
(3)写出向C溶液中通入过量CO2的离子方程式
(4)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示.写出该氢氧化钾溶液中通入Y2的化学方程式:

查看习题详情和答案>>
| 信 息 | |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素. |
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因
(3)写出向C溶液中通入过量CO2的离子方程式
(4)电解饱和J溶液产物之一为Y2,将一定量的Y2通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示.写出该氢氧化钾溶液中通入Y2的化学方程式:

 A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表.Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子.| A | B | D | E | |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
.(2)Fe、Co两元素的第三电离能I3(Fe)
<
<
I3(Co)(填“<”或“>”).(3)B、D、E的气态氢化物的沸点由高到低的顺序为
H2O>NH3>H2S
H2O>NH3>H2S
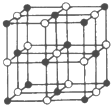
(填化学式).(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为
CoO
CoO
.(用元素符号表示)(5)Co的离子能与AD-离子生成各种配合物.紫色的配离子[Co(AD)6]4- 是一种相当强的还原剂,在加热时能与水反应生
成[Co(AD)6]3-.
①HAD分子中A元素的杂化类型为
sp
sp
,D元素的化合价为-3
-3
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式:
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-
| ||
2[Co(CN)6]4-+2H2O
2[Co(CN)6]3-+H2↑+2OH-
.
| ||
(2013?江苏三模)实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3.其工艺流程为:
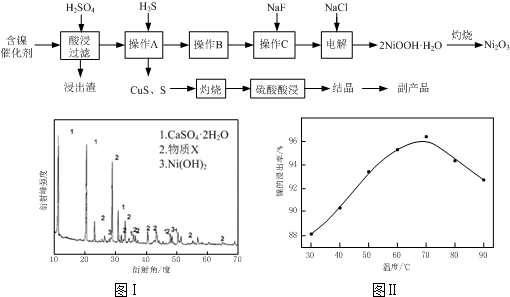
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为
(2)工艺流程中“副产品”的化学式为
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤.请对该实验方案进行评价:
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol?L-1,则Ca2+的浓度为
(5)电解产生2NiOOH?H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH?H2O沉淀.第②步反应的离子方程式为
查看习题详情和答案>>

(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为
BaSO4
BaSO4
.图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是温度升高,Ni2+的水解程度增大
温度升高,Ni2+的水解程度增大
.(2)工艺流程中“副产品”的化学式为
CuSO4?5H2O
CuSO4?5H2O
.(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
方案错误;在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+
方案错误;在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+
(若原方案正确,请说明理由;若原方案错误,请加以改正).(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol?L-1,则Ca2+的浓度为
3×10-6
3×10-6
mol?L-1.(常温时CaF2的溶度积常数为2.7×10-11)(5)电解产生2NiOOH?H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH?H2O沉淀.第②步反应的离子方程式为
ClO-+2Ni2++4OH-=2NiOOH?H2O+Cl-
ClO-+2Ni2++4OH-=2NiOOH?H2O+Cl-
.