摘要:计算.有机.分量加大 涉及计算的选择题中有4道.非选择题中有1道.比往年增多,涉及有机的选择题中有2道.非选择题中有1道.也比往年多. 总之.09年高考化学试题.立足基础.遵循考纲.注重能力.稳中求实.稳中求变.变中求新.新中求活.基础加创新.原汁原味考化学.是一套值得肯定的好题.
网址:http://m.1010jiajiao.com/timu_id_4357364[举报]
某含氧有机化合物A可以作为无铅汽油的抗爆震剂,同温同压下气态A对氢气的相对密度是44,含C的质量分数为68.2%,含H的质量分数为13.6%,核磁共振氢谱图中峰面积之比为3:1。
(1)计算该有机化合物的分子式。
(2)请写出其结构简式。
查看习题详情和答案>> KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.
KMnO4的氧化性随pH的减小而增大.其在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2.(1)应该在
(2)在亚硫酸溶液中滴入酸性KMnO4溶液.将该反应的氧化剂、还原剂和配平后的系数填入正确位置,并标出电子转移的方向和数目
(3)三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式
(4)加入过量的KMnO4才能将水中的三氯乙烯彻底除去.已知n(KMnO4):n(C2HCl3)=5:1时,水样中的三氯乙烯基本完全去除.某地下水样品中三氯乙烯的质量浓度为1×10-4g/L,计算每处理1m3该地下水,需KMnO4
《实验化学》茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量(已知茶叶中的铝、铁元素对钙离子的测定有影响),设计了探究实验方案如下:
步骤1:称取250g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将100mL 2mol?L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500mL,取其中的25.00mL溶液以酚酞作指示剂,用0.1000mol?L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为25.00mL,计算结果.
请回答下列问题:
(1)步骤 1中,使茶叶灰化需要的仪器有三角架、泥三角、酒精喷灯、 .
(2)步骤2中,改用试剂 来调节pH将更为方便;判断沉淀已经洗涤干净的方法是 .
(3)步骤3中,被滴定的25mL滤液中 CO32-的物质的量为 mol,
(4)原茶叶中钙离子的质量分数为 .若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将 .
A.偏小 B.偏大 C.无影响 D.偏小或偏大或无影响.
查看习题详情和答案>>
步骤1:称取250g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将100mL 2mol?L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500mL,取其中的25.00mL溶液以酚酞作指示剂,用0.1000mol?L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为25.00mL,计算结果.
请回答下列问题:
(1)步骤 1中,使茶叶灰化需要的仪器有三角架、泥三角、酒精喷灯、
(2)步骤2中,改用试剂
(3)步骤3中,被滴定的25mL滤液中 CO32-的物质的量为
(4)原茶叶中钙离子的质量分数为
A.偏小 B.偏大 C.无影响 D.偏小或偏大或无影响.
草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
(1)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度.甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn?H++In-.则酸根离子In-的颜色是 .甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断).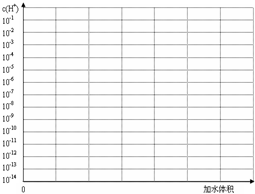
(3)常温下有pH均为3的盐酸和草酸溶液各10ml,加水稀释,在右图画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注.
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全.
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1mol/L(NH4)2C2O4溶液pH值6.4.现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是 (填字母).
A.5 B.6 C.7 D.9.
查看习题详情和答案>>
(1)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10ml | 10ml | 40s |
| 40℃ | 20ml | 20ml |

(3)常温下有pH均为3的盐酸和草酸溶液各10ml,加水稀释,在右图画出稀释过程中两种溶液中c(H+)变化的示意图并作必要的标注.
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全.
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1mol/L(NH4)2C2O4溶液pH值6.4.现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5mol/L,该溶液pH可能是
A.5 B.6 C.7 D.9.
(2012?河东区一模)室内甲醛污染已被列入对公众健康影响最大的环境因素之一,市面上有一种光催化涂料,能够起到降低室内甲醛含量的作用.某化学兴趣小组想要通过此涂料来进行甲醛的光催化氧化反应,并测定被氧化的甲醛的量.设计实验装置如下:

实验时先开启紫外灯,缓缓鼓入空气;一段时间后停止反应,关闭紫外灯,再继续通入一会儿空气,向B中加入足量BaCl2溶液,得到白色沉淀5.91g.
(1)福尔马林是催化氧化甲醇制得的含甲醛37%的水溶液,因此含有二种有机杂质,它们是
(2)上图装置A中,碱石灰的作用是
(3)硬质玻璃管中,甲醛在光催化氧化条件下的反应方程式:
(4)向B中加入足量BaCl2溶液后至得到5.91g白色沉淀的一系列操作依次是:过滤、
(5)计算被氧化的甲醛的物质的量为
(6)反应结束后,继续遭入一会儿空气的目的是
(7)甲同学认为,反应过程中部分甲醛可能被氧化为甲酸.为验证其存在,甲同学取B中溶液,分别选用下表试剂进行检验.但乙同学认为试剂选择均不合理,他的理由是:
查看习题详情和答案>>

实验时先开启紫外灯,缓缓鼓入空气;一段时间后停止反应,关闭紫外灯,再继续通入一会儿空气,向B中加入足量BaCl2溶液,得到白色沉淀5.91g.
(1)福尔马林是催化氧化甲醇制得的含甲醛37%的水溶液,因此含有二种有机杂质,它们是
甲醇
甲醇
,甲酸
甲酸
,福尔马林的一个用途是浸制生物标本
浸制生物标本
.(2)上图装置A中,碱石灰的作用是
吸收空气中的CO2
吸收空气中的CO2
,恒温水浴的目的是使混合气中甲醛含量稳定(写使甲醛挥发亦可)
使混合气中甲醛含量稳定(写使甲醛挥发亦可)
.(3)硬质玻璃管中,甲醛在光催化氧化条件下的反应方程式:
HCHO+O2
CO2+H2O
| 催化剂 |
| 紫外光 |
HCHO+O2
CO2+H2O
;| 催化剂 |
| 紫外光 |
(4)向B中加入足量BaCl2溶液后至得到5.91g白色沉淀的一系列操作依次是:过滤、
洗涤
洗涤
、干燥、称量
称量
;过滤时需用的玻璃仪器除烧杯、玻璃棒外还有普通漏斗
普通漏斗
.(5)计算被氧化的甲醛的物质的量为
0.03
0.03
mol(6)反应结束后,继续遭入一会儿空气的目的是
将残留在装置中的、CO2排出,被NaOH吸收,减小误差
将残留在装置中的、CO2排出,被NaOH吸收,减小误差
.(7)甲同学认为,反应过程中部分甲醛可能被氧化为甲酸.为验证其存在,甲同学取B中溶液,分别选用下表试剂进行检验.但乙同学认为试剂选择均不合理,他的理由是:
| 甲同学选择的试剂 | 乙同学认为不合理的理由 |
| 紫色石蕊试液 | 紫色石蕊试液B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) 紫色石蕊试液B中溶液呈碱性(NaOH足量),无法证明是甲酸(酸性) |
| 新制氢氧化铜 | B中可能溶有过量的甲醛,无法证明是甲酸中醛基 B中可能溶有过量的甲醛,无法证明是甲酸中醛基 |