摘要:367.向20mL 0.2mol/L氢氧化钠溶液中.缓缓通入一定量CO2气体.将溶液在一定条件下蒸干.若得到的白色固体是纯净物.则通入CO2的体积应为 .写出有关反应的离子方程式 .将上述白色固体加水溶解.加盐酸至pH=7.再蒸干得到白色固体的质量应为 g.
网址:http://m.1010jiajiao.com/timu_id_4354024[举报]
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | C、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) | D、向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
 (2012?浦东新区二模)室温时,向20mL 0.1mol/L的醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是( )
(2012?浦东新区二模)室温时,向20mL 0.1mol/L的醋酸溶液中不断滴入0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是( )
查看习题详情和答案>>
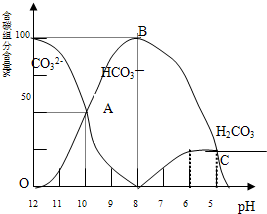 常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:
常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是(用离子方程式表示)
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%.请你设计简单实验证明该同学的观点是否正确
(3)若向20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则Ksp(X)=
(4)请写出OAB段的离子方程式
 25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是( )
25℃时,向20mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中,正确的是( )| A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | B、在A点:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | C、在B点:c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D、在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |