摘要:4.氯化铵晶体与消石灰的固体混合物90.5g.在150℃下加热至质量不再减少为止.得到残渣40.5g.则原混合物中氯化铵和消石灰的物质的量之比( ) A.等于2:1 B.大于2:1 C.小于2:1 D.等于1:1
网址:http://m.1010jiajiao.com/timu_id_4347302[举报]
氯化铵晶体与消石灰的固体混合物90.5g,在150℃下加热至质量不再减少为止,得到残渣40.5g。则原混合物中氯化铵和消石灰的物质的量之比
[ ]
A.等于2:1
B.大于2:1
C.小于2:1
D.等于1:1
查看习题详情和答案>>
B.大于2:1
C.小于2:1
D.等于1:1
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组用模拟制备氨基甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g) ![]() NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用右图装置制取氨气,选择的试剂可以是(填序号)
A.氯化铵固体与消石灰固体 B.浓氨水与碱石灰
C.浓氨水与NaOH固体 D.氯化铵溶液与烧碱溶液
(2)制备氨基甲酸铵的装置如下图,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。 当悬浮物较多时,停止制备。(注:四氯化碳与液体石蜡均为惰性介质)
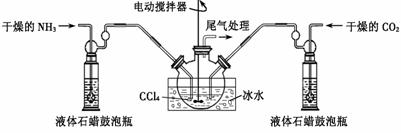
 ①发生器用冰水冷却的原因是________ __ _;液体石蜡鼓泡瓶的作用是______________________________ __。
①发生器用冰水冷却的原因是________ __ _;液体石蜡鼓泡瓶的作用是______________________________ __。
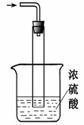
②尾气处理装置如右图所示。
双通玻璃管的作用: ;
浓硫酸的作用: 、________ _。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.7820 g,用足量石灰水充分处理后,使所有碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000 g。则样品中氨基甲酸铵的物质的量分数为____________。
[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(CaCO3)=100]
查看习题详情和答案>>