摘要:例1.已知周期表中.元素Q.R.W.Y与元素X相邻.Y的最高化合价氧化物的水化物是强酸.回答下列问题: (1)W与Q可以形成一种高温结构陶瓷材料.W的氯化物分子呈正四面体结构.W的氧化物的晶体类型是 , (2)Q的具有相同化合价且可以相互转变的氧化物是 , (3)R和Y形成的二元化合物中.R呈现最高化合价的化合物的化学式是 , (4)这5个元素的氢化物分子中.①立体结构类型相同的氢化物的沸点从高到低排列次序是 .其原因是 , ②电子总数相同的氢化物的化学式和立体结构分别是 , (5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应.生成化合物W(QH2)4和HCL气体,W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料.上述相关反应的化学方程式是 . [解析]本题可结合问题作答.W的氯化物为正四体型.则应为SiCl4或CCl4.又W与Q形成高温陶瓷.故可推断W为Si.(1)SiO2为原子晶体.(2)高温陶瓷可联想到Si3N4,Q为N.则有NO2与N2O4之间的相互转化关系.(3)Y的最高价氧化的的水化物为强酸.且与Si.N等相邻.则只能是S.R为As.所以R的最高价化合物应为As2S5.(4)显然x为P元素.①氢化物沸点顺序为NH3> AsH3 > PH3,因为前者中含有氢键后两者构型相同.分子间作用 力不同.②SiH4.PH3和H2S的电子数均为18..结构分别为正四面体.三角锥和V形.(5)由题中所给出的含字母的化学式可以写出具体的物质.然后配平即可 [答案]NO2和N2O4(3)As2S5.(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同.分子间作用力不同,②电子数相同的有SiH4.PH3和H2S结构分别为正四面体.三角锥和V形.(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl.3Si(NH2)4 = 8NH3 + Si3N4 例2.(1)氰化钾.氰化氢的制备反应式为: K2CO3+C+2NH32KCN+3H2O,△H=+276kJ/mol ① CO+NH3HCN+H2O,△H=+46kJ/mol ② 氰离子为负一价(CN-).其中碳氮元素的化合价分别为 . 以上两个反应是否均为氧化还原反应? (2)制备纯净无水HCN的另一种方法是 :混合磨细的KCN和KHS粉末适度加热①试写出这个反应式.②为什么要磨细和用粉末?③为什么要强调适度加热? [解析]据共价键理论.一般当碳同非金属性比它强的元素结合时.碳显正价.氮为负价.为-3价.所以(CN-)中碳为+2价.氮为-3价.故①为氧化还原反应.②为非氧化 还原反应.第二种方法制备HCN是固体与固体之间的反应.故磨细和用粉末的目的是增大表面积.加快反应速率.据题意知.第二种方法制备HCN如温度太低.反应速率较小.温度太高.则酸式盐易分解发生副反应:2KHSK2S+H2S↑.该反应的化学方程式为KCN+KHSHCN↑+K2S. [答案] (1)-3.①为氧化还原反应.②为非氧化还原反应. (2)KCN+KHSHCN↑+K2S. 第二种方法制备HCN是固体与固体之间的反应.故磨细和用粉末的目的是增大表面积.加快反应速率.
网址:http://m.1010jiajiao.com/timu_id_4336841[举报]
 (2010?湘潭三模)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
(2010?湘潭三模)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).(1)若A是单质,X气体是09年12月哥本哈根世界气候大会力争实现减排的主要物质,则B与D反应的离子方程式为
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.(2)若A为淡黄色化合物,D为14电子的双原子气体分子,有毒,则A的电子式为


(3)若D为白色胶状沉淀,且摩尔质量与A相等,则X中一定含
Al
Al
元素(填元素符号)(4)若C可作水是要催熟剂,E是难溶于水的固体,写出A和水反应的化学方程式
MgC2+H2O═C2H2+Mg(OH)2
MgC2+H2O═C2H2+Mg(OH)2
.下列说法错误的是( )
| A、08年北京奥运会开幕式上的“脚印”等焰火让全世界为之欢呼、倾倒,这主要是利用了化学中“焰色反应”的知识 | B、我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 | C、中国第1艘LNG船“大鹏昊”已于09年5月2日满载65000吨LNG,抵达广东.船底镶嵌锌块,锌作负极,以防船体被腐蚀 | D、2008年诺贝尔化学奖被授予研究“绿色荧光蛋白质”的美籍华裔科学家钱永健等人.蛋白质都是由氨基酸形成的不可降解的高分子化合物,其水溶液有丁达尔效应 |
《化学与生活》
(1)关注食品安全,关爱身体健康.
①下列维生素中,可用于防治坏血病的是 (填字母).
a.维生素A b.维生素B1 c.维生素C
②在食品加工或餐饮业中,特别要严加控制用量的物质是 (填字母).
a.氯化钠 b.碳酸氢钠 c.亚硝酸钠
③青霉素适合治疗的疾病是 (填字母).
a.感冒发烧 b.细菌感染 c.胃酸过多
(2)合理使用材料,改善人类生活.
①钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人.金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生 的过程.为防止轮船船体在海水中被腐蚀,一般在船身连接 (选填“锌块”或“铜块”).
②在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是 .橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为 结构,从而增大橡胶的强度.
(3)中共十八大报告提出:“大力推进生态文明建设”.
①燃煤是增加大气PM2.5数值,形成雾霾天气的罪魁祸首之一.煤的气化是高效、清洁地利用煤炭的重要途径,写出灼热的焦炭与水蒸气反应的化学方程式 .
②餐饮业产生的“地沟油”的主要成分是油脂.综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取高级脂肪酸和 (填名称).将废弃塑料进行 处理,可以获得乙烯、丙烯等化工原料.
③防治重金属污染是2013年全国环保工作的重点.向含有Hg2+的废水中加入Na2S,可以使Hg2+转变成沉淀,离子反应方程式为 .
④我国生活垃圾一般可分为以下四大类:可回收垃圾、厨余垃圾、有害垃圾和其他垃圾.以下物质属于可回收垃圾的是 (填字母).
a.废报纸 b.废铝制易拉罐 c.过期药品 d.渣土. 查看习题详情和答案>>
(1)关注食品安全,关爱身体健康.
①下列维生素中,可用于防治坏血病的是
a.维生素A b.维生素B1 c.维生素C
②在食品加工或餐饮业中,特别要严加控制用量的物质是
a.氯化钠 b.碳酸氢钠 c.亚硝酸钠
③青霉素适合治疗的疾病是
a.感冒发烧 b.细菌感染 c.胃酸过多
(2)合理使用材料,改善人类生活.
①钢铁是人类生产和生活中非常重要的材料,但每年因锈蚀而损失的数量十分惊人.金属腐蚀分为化学腐蚀和电化学腐蚀,两者的微观本质都是发生
②在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
(3)中共十八大报告提出:“大力推进生态文明建设”.
①燃煤是增加大气PM2.5数值,形成雾霾天气的罪魁祸首之一.煤的气化是高效、清洁地利用煤炭的重要途径,写出灼热的焦炭与水蒸气反应的化学方程式
②餐饮业产生的“地沟油”的主要成分是油脂.综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取高级脂肪酸和
③防治重金属污染是2013年全国环保工作的重点.向含有Hg2+的废水中加入Na2S,可以使Hg2+转变成沉淀,离子反应方程式为
④我国生活垃圾一般可分为以下四大类:可回收垃圾、厨余垃圾、有害垃圾和其他垃圾.以下物质属于可回收垃圾的是
a.废报纸 b.废铝制易拉罐 c.过期药品 d.渣土. 查看习题详情和答案>>
曾经有两条新闻引起全国人民的广泛关注:
{1}2003年5月25日,中央电视台《新闻联播》报道,“西气东输”工程进展迅速,2004年东部沿海城市可以用到质优价廉的天然气.
{2}2003年5月13日,安徽淮北芦岭煤矿发生特大瓦斯爆炸(瓦斯的主要成分是甲烷)造成重大伤亡.
(1)写出天然气完全燃烧的化学方程式:
(2)请用化学知识分析瓦斯爆炸的原因:
(3)上面两个例子说明,化学物质可以造福人类,但有时也给人类带来危害.请你再举生活中的一种有机物说明这个问题:
查看习题详情和答案>>
{1}2003年5月25日,中央电视台《新闻联播》报道,“西气东输”工程进展迅速,2004年东部沿海城市可以用到质优价廉的天然气.
{2}2003年5月13日,安徽淮北芦岭煤矿发生特大瓦斯爆炸(瓦斯的主要成分是甲烷)造成重大伤亡.
(1)写出天然气完全燃烧的化学方程式:
CH4+2O2
CO2+2H2O
| ||
CH4+2O2
CO2+2H2O
;
| ||
(2)请用化学知识分析瓦斯爆炸的原因:
甲烷在空气中的含量达到爆炸极限,遇明火,就会发生爆炸
甲烷在空气中的含量达到爆炸极限,遇明火,就会发生爆炸
;(3)上面两个例子说明,化学物质可以造福人类,但有时也给人类带来危害.请你再举生活中的一种有机物说明这个问题:
塑料袋,有利的一面是方便人们装物品,不利的一面是造成环境污染
塑料袋,有利的一面是方便人们装物品,不利的一面是造成环境污染
.2013年全国各地都遭遇“十面霾伏”.其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
2CO2(g)+N2(g).△H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图甲正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号).
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
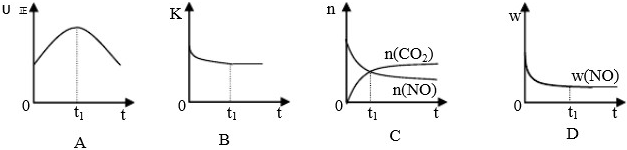
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol
H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: .
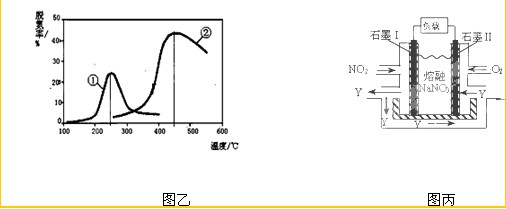
(3)用NH3催化还原NOX也可以消除氮氧化物的污染.图乙,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
①该反应的△S 0,△H 0(填“>”、“=”或“<”).
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP= .
③以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图丙.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 .
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去.反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为 g.
查看习题详情和答案>>
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
| 催化剂 |
若该反应在绝热、恒容的密闭体系中进行,下列示意图甲正确且能说明反应在进行到t1时刻达到平衡状态的是
(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)


(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol
H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:
(3)用NH3催化还原NOX也可以消除氮氧化物的污染.图乙,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g).
①该反应的△S
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则上述反应的KP=
③以下说法正确的是
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理见图丙.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
(5)硝酸工业尾气中氮氧化物(NO和NO2)可用尿素〔CO(NH2)2〕溶液除去.反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为