摘要:装置图
网址:http://m.1010jiajiao.com/timu_id_4331341[举报]
 28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
28、物质之间发生化学反应时,常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.【方案一】:先在NaOH稀溶液中滴加几滴酚酞试液,溶液显
红
色,然后再滴加盐酸,当观察到红色褪去
,证明NaOH溶液与稀盐酸发生了化学反应.当得到无色溶液时,小虎认为这时酸与碱恰好完全反应.小英却认为这时还应该存在的另一种情况是盐酸过量
.接着老师又提出问题:红色消失一定证明是酸与碱发生中和反应吗?他们经过讨论认为也可能是酚酞与酸反应而褪色.这时应在溶液中再滴加酚酞(或氢氧化钠溶液)
溶液,若有不变红(或变红)
现象,则证明不是酚酞与酸反应而褪色.【方案二】:用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应.这时小虎又提出疑问:pH逐渐变小,可能是由于溶液稀释造成的,不能说明一定发生了反应.小全对小虎的疑问进行了反驳,他的理由是:
碱溶液无论如何稀释,其pH值都不可能小于7
.测定溶液的pH时,需在白瓷板或玻璃片上放一小片pH试纸,用
滴管或玻璃棒
把待测液滴在pH试纸上,过一会儿,将试纸的颜色与标准比色卡
比较,从而得出溶液的pH.若对一未知溶液用湿润的pH试纸来测定溶液的pH,则测定的结果会D
.A.偏大,B.偏小,C.不变,D.以上三种可能都有
【方案三】:在试管中放入一粒NaOH固体,然后加入稀盐酸.
小华看到氢氧化钠固体消失了,认为发生了反应.而小全想了想之后却不同意小华的观点,小全的理由是:
可能是氢氧化钠溶于水
.小明用手摸了摸试管外壁,试管比较热,他认为不仅说明它们发生了反应,而且是放热反应.小全思考之后仍然不同意小明的观点,小全的理由是:氢氧化钠溶于水也放热
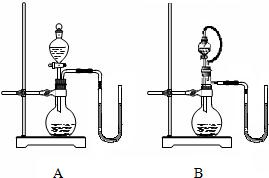
.乙同学和丙同学各设计了一个装置(见右图),都说在不使用温度计的情况下可以判断NaOH溶液与稀盐酸发生了中和反应.分析说明:
B
(填序号)装置更合理,理由是B装置能排除因液体的滴入而造成烧瓶内气体排出,引起玻璃管内液面发生变化
.若选用合理的装置进行实验,当出现玻璃管中左侧液面下降,右侧液面上升
现象时,可以说明NaOH溶液与稀盐酸发生了反应.【方案四】:可以通过测定反应前的物质不存在来判断反应的发生.将一定量的稀盐酸溶液平均分为两份,一份直接加入锌粒中,观察到的现象是
有气泡产生
;向另一份中先加入过量的NaOH溶液,再加入锌粒中,观察到无气泡产生
现象,说明NaOH溶液和HCl溶液发生了反应.锌粒与稀盐酸反应的化学方程式为Zn+2HCl═ZnCl2+H2↑
.【方案五】:定量研究是化学研究中的一种重要的方法.一同学将200 mL稀盐酸平均分成两份,其中一份直接加入到w g的CaCO3中,充分反应后收集到V1体积的CO2;向另一份中先滴加一定量的NaOH溶液,充分反应后,也加入到w g的CaCO3中,反应后收集到V2体积的CO2.如果V1
>
V2(填“>”或“<”或“=”)也能说明NaOH溶液和HCl溶液发生了反应.(2002?吉林)某同学设计了一套用电解水产生氢气还原氧化铜,并收集氧气的装置(见图).
根据装置图回答:B装置中正极与负极产生气体的体积比为

查看习题详情和答案>>
根据装置图回答:B装置中正极与负极产生气体的体积比为
1:2
1:2
;图中多余的装置是D
D
.
根据下列制取氧气的装置图回答问题.

(1)写出仪器①、②的名称①
(2)实验室常用高锰酸钾或过氧化氢和二氧化锰来制取氧气,你认为其中相对较好的方法是
(3)何洁同学在制取氧气过程中,她收集一瓶氧气后,用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃.其原因可能是
查看习题详情和答案>>

(1)写出仪器①、②的名称①
酒精灯
酒精灯
;②集气瓶
集气瓶
.(2)实验室常用高锰酸钾或过氧化氢和二氧化锰来制取氧气,你认为其中相对较好的方法是
用过氧化氢和二氧化锰来制取氧气
用过氧化氢和二氧化锰来制取氧气
,其理由是不需加热(或可以控制反应速率或生成物对环境没有污染)
不需加热(或可以控制反应速率或生成物对环境没有污染)
.(3)何洁同学在制取氧气过程中,她收集一瓶氧气后,用带火星的木条伸入瓶口、瓶中、瓶底,都未见木条复燃.其原因可能是
装置气密性不好(或用错药品或药品变质或收集的时间不够长)
装置气密性不好(或用错药品或药品变质或收集的时间不够长)
.实验室常用下列装置制取气体,请你根据所学知识回答下列问题.

(1)写出编号所指仪器的名称:①
(2)以上装置图中共有两处明显的错误,请你找出错误的地方并把改正的结果填在下列横线上:①
上述装置改进后,请继续回答下列问题.
(3)你和小明一起进行实验室制取二氧化碳的探究.
①选择药品.小明对三组药品进行了研究,实验记录如下:
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的文字表达式为
不选择第③组药品的原因是
②选择装置.通过对制取气体装置的分析,他选择用B或者C的发生装置.你认为他选择的依据是
③制取气体.将药品装入所选装置制取气体,并用装置E来收集二氧化碳气体,验满方法是
有一名同学欲用G来代替E,则气体应从导管口
(4)小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,按要求收集气体.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二、三组实验,三组实验的数据和现象见表.
请根据实验回答下列问题:
①为了达到实验目的必须用排水法收集氧气.请你帮小亮选出制取氧气的发生和收集装置
②使用带火星的木条验满氧气的方法是否可靠:
③集气瓶中氧气的体积分数=收集的氧气占容积的体积分数+瓶中空气占容积的体积分数×
④收集的氧气占容积的体积分数最低为
⑤用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如下图所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在

⑥采取“半值法”探究能减少实验次数.例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验.同理,第二组实验可以省去的实验编号为
查看习题详情和答案>>

(1)写出编号所指仪器的名称:①
长颈漏斗
长颈漏斗
;②集气瓶
集气瓶
.(2)以上装置图中共有两处明显的错误,请你找出错误的地方并把改正的结果填在下列横线上:①
错误:试管口向上倾斜,改正:试管口稍向下倾斜.
错误:试管口向上倾斜,改正:试管口稍向下倾斜.
;②错误:向上排空气法收集气体的导管未伸入到接近瓶底,改正:向上排空气法收集气体的导管应伸入到接近瓶底.
错误:向上排空气法收集气体的导管未伸入到接近瓶底,改正:向上排空气法收集气体的导管应伸入到接近瓶底.
.上述装置改进后,请继续回答下列问题.
(3)你和小明一起进行实验室制取二氧化碳的探究.
①选择药品.小明对三组药品进行了研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
碳酸钙+盐酸→氯化钙+二氧化碳+水
碳酸钙+盐酸→氯化钙+二氧化碳+水
;不选择第③组药品的原因是
产生气体速率很快,不易收集
产生气体速率很快,不易收集
.②选择装置.通过对制取气体装置的分析,他选择用B或者C的发生装置.你认为他选择的依据是
固液常温下反应制取气体
固液常温下反应制取气体
.比较这两个装置的不同,指出B装置的一个突出优点可以控制反应的发生和停止
可以控制反应的发生和停止
.③制取气体.将药品装入所选装置制取气体,并用装置E来收集二氧化碳气体,验满方法是
将燃着的木条伸入瓶口处,若木条熄灭,则证明收集满了
将燃着的木条伸入瓶口处,若木条熄灭,则证明收集满了
.有一名同学欲用G来代替E,则气体应从导管口
a
a
通入.(4)小亮发现:收集的氧气占集气瓶容积的60%(空气占40%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?小亮对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,按要求收集气体.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小亮在前一组实验的基础上又做了第二、三组实验,三组实验的数据和现象见表.
| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | l0 | 20 | 30 | 40 | 50 | 3l | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
①为了达到实验目的必须用排水法收集氧气.请你帮小亮选出制取氧气的发生和收集装置
B
B
,写出制取氧气的化学反应文字表达式2H2O2
O2↑+2H2O
| ||
2H2O2
O2↑+2H2O
.若用G来代替收集装置,则气体应从导管口
| ||
a
a
通入.②使用带火星的木条验满氧气的方法是否可靠:
否
否
(填“是”或“否”).③集气瓶中氧气的体积分数=收集的氧气占容积的体积分数+瓶中空气占容积的体积分数×
21
21
%.④收集的氧气占容积的体积分数最低为
35
35
%时,可使带火星的木条复燃,这时集气瓶中氧气分数是49
49
%(计算结果保留整数).⑤用带火星的木条直接检验双氧水受热分解产生的氧气时,往往难以复燃,这是因为在加热生成氧气的同时产生大量水蒸汽所致,此时混合气体中氧气的体积分数随温度变化的曲线如下图所示.若只考虑氧气的体积分数对实验结果的影响,欲使带火星的木条复燃,应将加热双氧水的最高温度控制在
82
82
℃.
⑥采取“半值法”探究能减少实验次数.例如:第一组实验若按③、④的编号顺序进行实验,即可确定下一组实验收集的氧气占容积的体积分数应在30%~40%之间,从而省去编号为①、②、⑤的实验.同理,第二组实验可以省去的实验编号为
①、④、⑤
①、④、⑤
. 26、用氯气或液氯消毒饮用水时,会和水中的有机物发生反应,生成对人体有毒的有机物.因此,世界环保联盟将全面禁止用氯气对饮用水消毒,建议推广采用安全、高效杀菌消毒剂ClO2.
26、用氯气或液氯消毒饮用水时,会和水中的有机物发生反应,生成对人体有毒的有机物.因此,世界环保联盟将全面禁止用氯气对饮用水消毒,建议推广采用安全、高效杀菌消毒剂ClO2.ClO2 是一种黄绿色、有刺激性气味的气体,熔点:-59.0℃,沸点:11.0℃,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解.ClO2易与碱反应,其杀菌、漂白能力均优于Cl2,消毒水体时不生成有害物质,也不存在用氯气消毒时残留的臭味.
(1)制取ClO2的方法有多种,目前欧洲一些国家用NaClO3氧化浓盐酸制取ClO2(Kestiog法)同时有Cl2生成,该反应的化学方程式为
2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl
.(2)我国最近研究成功用Cl2氧化NaClO2(N2保护下)制取ClO2,该反应的化学方程式是
2NaClO2+Cl2=2ClO2↑+2NaCl
;此法与Kestiog法相比,其优点是无有害气体生成,产品易分离
.(3)工业上也可以在60℃时,用稍加潮湿的KClO3与草酸(HOOCCOOH)反应制取ClO2.某实验小组用下图所示装置制取并收集ClO2,在装置图中A为ClO2的发生装置,B为ClO2的收集装置,C为尾气吸收装置.请问:
①为了保证实验成功,在A装置外面需加
60℃水
、B装置外面需加冰水
;②C中所盛放的药品是氢氧化钠溶液
.