摘要:除去气体中的水蒸气通常叫干燥.除去气体中的其它杂质通常叫洗气.除去气体中杂质通常有以下装置:
网址:http://m.1010jiajiao.com/timu_id_4064229[举报]
(2013?房山区一模)某黄铜矿样品标注显示:主要成分为CuFeS2(含81.5%),其余多为脉石(SiO2).为检验该黄铜矿的纯度是否与标注一致,设计了如下实验:
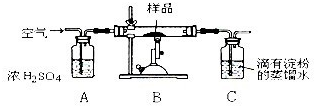
已知:①在空气存在下煅烧黄铜矿,生成Cu、Fe3O4和SO2气体.②亚硫酸易被氧化:2H2SO3+O2=2H2SO4
请回答下列问题:
(1)检验装置气密性后,称取研细的黄铜矿样品1.150g,放入硬质玻璃管中,研细的目的是
(2)通入空气一段时间后,点燃酒精喷灯加热样品,充分反应,装置B、装置C中反应的化学方程式分别是
(3)反应过程中,装置A的作用是
①除去空气中的二氧化碳 ②除去空气中的水蒸气 ③使空气成分均匀混合 ④用于观察、控制空气流速
(4)反应结束前的操作是:先撤掉酒精喷灯,再
(5)取装置C中溶液的1/10置于锥形瓶中,用0.05mol?L-1标准碘溶液进行滴定,反应的离子方程式为
查看习题详情和答案>>

已知:①在空气存在下煅烧黄铜矿,生成Cu、Fe3O4和SO2气体.②亚硫酸易被氧化:2H2SO3+O2=2H2SO4
请回答下列问题:
(1)检验装置气密性后,称取研细的黄铜矿样品1.150g,放入硬质玻璃管中,研细的目的是
使样品快速、充分反应
使样品快速、充分反应
.(2)通入空气一段时间后,点燃酒精喷灯加热样品,充分反应,装置B、装置C中反应的化学方程式分别是
3CuFeS2+8O2
3Cu+Fe3O4+6SO2
| 高温 |
3CuFeS2+8O2
3Cu+Fe3O4+6SO2
、| 高温 |
SO2+H2O?H2SO3
SO2+H2O?H2SO3
.(3)反应过程中,装置A的作用是
②④
②④
(填序号).①除去空气中的二氧化碳 ②除去空气中的水蒸气 ③使空气成分均匀混合 ④用于观察、控制空气流速
(4)反应结束前的操作是:先撤掉酒精喷灯,再
通入空气至硬质玻璃管冷却
通入空气至硬质玻璃管冷却
,其目的是防止C中溶液倒吸且使装置内SO2被C溶液充分吸收反应
防止C中溶液倒吸且使装置内SO2被C溶液充分吸收反应
.(5)取装置C中溶液的1/10置于锥形瓶中,用0.05mol?L-1标准碘溶液进行滴定,反应的离子方程式为
I2+H2SO3=SO42-+2I-
I2+H2SO3=SO42-+2I-
;判断滴定达到终点的现象是无色溶液变蓝色
无色溶液变蓝色
;若滴定中消耗标准碘溶液20.00mL,则该黄铜矿的纯度测定结果比标注值偏低
偏低
(偏低或偏高),造成该结果的原因之一可能是SO2与H2O反应可逆致少量SO2跑掉或H2SO3易被氧化
SO2与H2O反应可逆致少量SO2跑掉或H2SO3易被氧化
,改进的建议是减慢通入空气的速度或改用NaOH淀粉溶液吸收SO2
减慢通入空气的速度或改用NaOH淀粉溶液吸收SO2
. 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
(1)写出该反应的反应方程式:
3Fe+4H2O(g)
Fe3O4+4H2↑
| ||
3Fe+4H2O(g)
Fe3O4+4H2↑
;并指明该氧化还原反应的还原剂是
| ||
Fe
Fe
,氧化剂是H2O
H2O
.(2)烧瓶底部放置了几片碎瓷片,碎瓷片作用是
防止暴沸
防止暴沸
.(3)干燥管中盛装是的物质是
碱石灰
碱石灰
,作用是除去氢气中的水蒸气
除去氢气中的水蒸气
.(4)试管中收集气体是
H2
H2
,如果要在A处玻璃管处点燃该气体,则必须对该气体进行验纯
验纯
.黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图2所示.请回答下列问题:
(1)将样品研细后再反应,其目的是
(2)装置a的作用是
a.有利于空气中氧气充分反应b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是
(4)滴定时,标准碘溶液所耗体积为
(5)若用如图3装置替代上述实验装置d,同样可以达到实验目的是
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有
查看习题详情和答案>>

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图2所示.请回答下列问题:
(1)将样品研细后再反应,其目的是
使原料充分反应、加快反应速率
使原料充分反应、加快反应速率
.(2)装置a的作用是
bd
bd
.a.有利于空气中氧气充分反应b.除去空气中的水蒸气
c.有利于气体混合 d.有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是
使反应生成的SO2全部进入d装置中,使结果精确
使反应生成的SO2全部进入d装置中,使结果精确
.(4)滴定时,标准碘溶液所耗体积为
20.00
20.00
mL.判断滴定已达终点的现象是溶液恰好由无色变成浅蓝色,且半分钟内不褪色
溶液恰好由无色变成浅蓝色,且半分钟内不褪色
.通过计算可知,该黄铜矿的纯度为80%
80%
.(5)若用如图3装置替代上述实验装置d,同样可以达到实验目的是
②
②
.(填编号)(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有
空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4
空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4
.黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石.为测定该黄铜矿的纯度,某同学设计了如图所示实验:
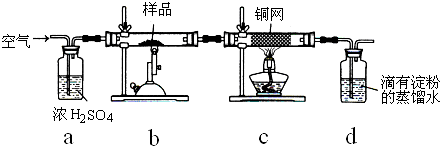
现用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
置于锥形瓶中,用0.05mol?L-1标准碘溶液进行滴定,消耗标准碘溶液20.00mL.请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中.
(2)装置a的作用是 .
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C.有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”) ,写出影响测定结果的化学方程式 .
(4)上述反应结束后,仍需通一段时间的空气,其目的是 .
(5)通过计算可知,该黄铜矿的纯度为 .
(6)假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有 .
查看习题详情和答案>>

现用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
| 1 | 10 |
(1)将样品研细后再进行反应,其目的是
(2)装置a的作用是
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C.有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”)
(4)上述反应结束后,仍需通一段时间的空气,其目的是
(5)通过计算可知,该黄铜矿的纯度为
(6)假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有
(2012?上海模拟)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,末读数如图1所示.
请回答下列问题:
(1)称量样品所用的仪器为
(2)装置a的作用是
A、有利于空气中氧气充分反应B、除去空气中的水蒸气
C、有利于气体混合D、有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是
(4)滴定时,标准碘溶液所耗体积为
(5)通过计算可知,该黄铜矿的纯度为
(6)若用图2装置替代上述实验装置d,同样可以达到实验目的是

查看习题详情和答案>>

现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的
| 1 | 10 |
请回答下列问题:
(1)称量样品所用的仪器为
电子天平
电子天平
,将样品研细后再反应,其目的是提高反应速率,并使黄铜矿充分反应
提高反应速率,并使黄铜矿充分反应
.(2)装置a的作用是
B、D
B、D
.A、有利于空气中氧气充分反应B、除去空气中的水蒸气
C、有利于气体混合D、有利于观察空气流速
(3)上述反应结束后,仍需通一段时间的空气,其目的是
把装置中的二氧化硫气体全部吸收
把装置中的二氧化硫气体全部吸收
.(4)滴定时,标准碘溶液所耗体积为
20.00
20.00
mL.判断滴定已达终点的现象是溶液由无色变成蓝色,并半分钟内不褪色
溶液由无色变成蓝色,并半分钟内不褪色
.(5)通过计算可知,该黄铜矿的纯度为
80%
80%
.(6)若用图2装置替代上述实验装置d,同样可以达到实验目的是
②
②
.(填编号)