摘要:反应的时间t=90-70=20s
网址:http://m.1010jiajiao.com/timu_id_4060419[举报]
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
X+2Y 2Z
2Z
 2Z
2ZX+2Y 2Z
2Z
; 2Z
2Z(2)该反应在0-3min时间内用产物Z表示的平均反应速率:
0.083mol/(L?min)
0.083mol/(L?min)
;(3)该反应达到平衡时反应物X的转化率为
45%
45%
;(4)如果该反应是放热反应.改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示),则曲线①、②、③所对应的实验条件改变分别是:①
升高温度
升高温度
、②加入催化剂
加入催化剂
、③加压
加压
.某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
(1)体系中发生反应的化学方程式是
(2)计算该反应在0~3min时间内产物Z的平均反应速率:
(3)该反应达到平衡时反应物X的转化率α等于
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1

(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4.00mol和0mol,在原温度下达平衡时,X的转化率为α!,则α!
(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,此时可逆反应的反应速率:υ(正)
查看习题详情和答案>>
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
X+2Y?2Z
X+2Y?2Z
;(2)计算该反应在0~3min时间内产物Z的平均反应速率:
0.017mol/L?min
0.017mol/L?min
;(3)该反应达到平衡时反应物X的转化率α等于
45%
45%
;(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1
升高温度
升高温度
,2使用合适的催化剂
使用合适的催化剂
,3增大压强
增大压强
.
(5)如果起始加入X、Y、Z的物质的量分别为2.00mol、4.00mol和0mol,在原温度下达平衡时,X的转化率为α!,则α!
>
>
α(填<>=).(6)如果在原温度下起始加入X、Y、Z的物质的量分别为1.00mol、1.00mol和1.00mol,此时可逆反应的反应速率:υ(正)
>
>
υ(逆)(填<>=).某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据下表中数据,在该题坐标图上画出X、Z的物质的量(n)随时间(t)变化的曲线:(图中已画出Y,用铅笔作图,并在你画出的曲线末端明确标出“x”或“z”)
 (2)体系中发生反应的化学方程式是
(2)体系中发生反应的化学方程式是
(3)列式并计算该反应在0-5min时间内产物Z的平均反应速率:
(4)该反应在第
(5)若使该反应的速率增加,下列措施一定不能达到目的是
A.升高温度 B.降低温度
C.使用催化剂 D.保持容器体积不变加入1molx和2moly.
查看习题详情和答案>>
(1)根据下表中数据,在该题坐标图上画出X、Z的物质的量(n)随时间(t)变化的曲线:(图中已画出Y,用铅笔作图,并在你画出的曲线末端明确标出“x”或“z”)
| t/min | X/mol | Y/mool | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| l | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 (2)体系中发生反应的化学方程式是
(2)体系中发生反应的化学方程式是X+2Y?2Z
X+2Y?2Z
;(3)列式并计算该反应在0-5min时间内产物Z的平均反应速率:
0.07mol?L-1?min-1
0.07mol?L-1?min-1
;(4)该反应在第
9
9
分钟(min)时达到平衡状态;(5)若使该反应的速率增加,下列措施一定不能达到目的是
B
B
.A.升高温度 B.降低温度
C.使用催化剂 D.保持容器体积不变加入1molx和2moly.
氮元素及其化合物在国防科学技术生产中有重要应用.
(1)写出实验室制NH3的化学反应方程式 .
(2)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 .
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
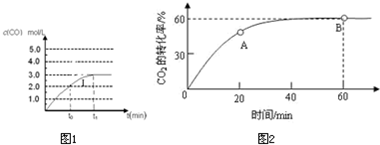
(4)在容积为2L容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),已知c(CO)与反应时间t变化曲线Ⅰ,若在t0时刻将容器的体积扩大至4L,请在图1中绘出c(CO)与反应时间t变化曲线Ⅱ.
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为 .
(6)合成尿素,当氨碳比
=4,CO2的转化率随时间的变化关系如图2所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”).
②NH3的平衡转化率为 .
查看习题详情和答案>>
(1)写出实验室制NH3的化学反应方程式
(2)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有

(4)在容积为2L容器中发生反应CO(g)+H2O(g)?CO2(g)+H2(g),已知c(CO)与反应时间t变化曲线Ⅰ,若在t0时刻将容器的体积扩大至4L,请在图1中绘出c(CO)与反应时间t变化曲线Ⅱ.
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
(6)合成尿素,当氨碳比
| n(NH3) | n(CO2) |
①A点的逆反应速率v逆(CO2)
②NH3的平衡转化率为
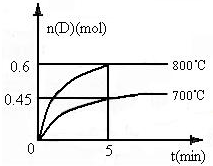 在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:
在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.请回答下列问题:(1)700℃时,0-5min内,以B表示的平均反应速率为
0.18mol/(L.min)
0.18mol/(L.min)
.(2)能判断该反应是否达到化学平衡状态的依据是(多选扣分)
AB
AB
.A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c (c)
(3)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
0.9
0.9
,该反应为吸热
吸热
反应(填“吸热”或“放热”).(4)800℃时,某时刻测得体系中各物质的物质的量浓度如下:c(A)=0.06mol?L-1,c(B)=0.50mol?L-1,c(C)=0.20mol?L-1,c(D)=0.018mol?L-1,则此时该反应
向正方向进行
向正方向进行
(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”).