摘要:实验现象:比空气中燃烧剧烈.发出白光.集气瓶内壁出现水珠.有使澄清石灰水变浑浊的无色无味气体产生. 文字表达式:石蜡+ 氧气(O2)二氧化碳(CO2)+ 水(H2O) 空气中燃烧情况:燃烧产生黄色火焰.放热.稍有黑烟.
网址:http://m.1010jiajiao.com/timu_id_4059267[举报]
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
 (1)甲同学选用如图1所示的装置制取氧气.
(1)甲同学选用如图1所示的装置制取氧气.
①写出仪器B的名称:
②甲同学应选取的试剂是Mn02和
③除用排水法外,甲同学还可选择
④实验前,甲同学先向仪器A中加入水,然后将导管放入水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现.该实验操作的目的是
(2)乙同学在学习了MnO2对过氧化氢分解有催化作用的知识后想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
[猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质改变;
Ⅲ.CuO是反应的催化剂,反应前后
[实验]用天平称量 0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:
①填写下表:
②步骤①的目的是
③步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
④过氧化氢能被CuO催化分解放出O2的化学方程式为
查看习题详情和答案>>
 (1)甲同学选用如图1所示的装置制取氧气.
(1)甲同学选用如图1所示的装置制取氧气.①写出仪器B的名称:
集气瓶
集气瓶
.②甲同学应选取的试剂是Mn02和
H2O2
H2O2
(填化学式).③除用排水法外,甲同学还可选择
向上排空气
向上排空气
法收集氧气.④实验前,甲同学先向仪器A中加入水,然后将导管放入水槽中,并打开仪器A的活塞,观察导管口是否有连续的气泡出现.该实验操作的目的是
检查装置的气密性
检查装置的气密性
.(2)乙同学在学习了MnO2对过氧化氢分解有催化作用的知识后想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
[猜想]Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质改变;
Ⅲ.CuO是反应的催化剂,反应前后
质量和化学性质不变
质量和化学性质不变
.[实验]用天平称量 0.2gCuO,取5mL5%的过氧化氢溶液于试管中,进行如图实验:
①填写下表:

| 步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
剧烈反应,产生大量气泡 剧烈反应,产生大量气泡 带火星的木条复燃. |
固体质量为0.2g 固体质量为0.2g |
溶液中有气泡放出, 带火星木条复燃 带火星木条复燃 |
猜想I、II不成立; 猜想III成立. |
与步骤③对比,检验加入氧化铜后双氧水的分解速率是否发生了变化
与步骤③对比,检验加入氧化铜后双氧水的分解速率是否发生了变化
.③步骤④需用到的实验仪器有:铁架台(带铁圈)、漏斗、烧杯、
玻璃棒
玻璃棒
.④过氧化氢能被CuO催化分解放出O2的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
我们每时每刻都生活在空气的“海洋”里.科学家很早就开始了对空气的研究.

(1)空气主要由
(2)实验室中可用图I所示的装置粗略研究空气的组成.反应的文字表达式是
(3)实验结束后此同学发现自己测定的氧气体积分数偏低,你认为造成该误差的可能原因是:(写出两条即可)
①
(4)不能用木炭代替红磷进行上述实验的原因是
(5)200年前,拉瓦锡用图II所示的装置研究了空气的组成.他把少量汞放在密闭的容器中连续加热,得到了红色的氧化汞粉末,同时钟罩内的汞液面上升.该化学反应的文字表达式是
(6)空气在标准状况下的密度是1.29g/L,以下四种气体中只能用排空气法收集的是
查看习题详情和答案>>

(1)空气主要由
氮气
氮气
和氧气组成,它们的体积比约为4:1
4:1
.(2)实验室中可用图I所示的装置粗略研究空气的组成.反应的文字表达式是
磷+氧气
五氧化二磷
| 点燃 |
磷+氧气
五氧化二磷
,红磷燃烧的主要现象为| 点燃 |
剧烈燃烧,放出大量热,产生大量白烟
剧烈燃烧,放出大量热,产生大量白烟
.(3)实验结束后此同学发现自己测定的氧气体积分数偏低,你认为造成该误差的可能原因是:(写出两条即可)
①
红磷量不足
红磷量不足
.②装置未冷却就打开止水夹(或塞子没塞紧、装置漏气)
装置未冷却就打开止水夹(或塞子没塞紧、装置漏气)
.(4)不能用木炭代替红磷进行上述实验的原因是
红磷与氧气反应生成的产物是固体,会造成压力差;木炭与氧气反应生成的二氧化碳为气体,不会造成压力差
红磷与氧气反应生成的产物是固体,会造成压力差;木炭与氧气反应生成的二氧化碳为气体,不会造成压力差
.(5)200年前,拉瓦锡用图II所示的装置研究了空气的组成.他把少量汞放在密闭的容器中连续加热,得到了红色的氧化汞粉末,同时钟罩内的汞液面上升.该化学反应的文字表达式是
汞+氧气
氧化汞
| 加热 |
汞+氧气
氧化汞
.汞液面上升的原因是| 加热 |
氧气与汞反应导致钟罩内气压降低
氧气与汞反应导致钟罩内气压降低
.(6)空气在标准状况下的密度是1.29g/L,以下四种气体中只能用排空气法收集的是
AC
AC
,既能用排水法收集,又能用向下排空气法收集的是D
D
.| 气体 | A | B | C | D |
| 标准状况下密度(g/L) | 1.997 | 1.429 | 0.771 | 0.717 |
| 在水中的溶解性 | 可溶 | 不易溶 | 易溶 | 难溶 |
 氮化镁“跑”到哪儿去了
氮化镁“跑”到哪儿去了小李老师发现,在空气中直接点燃镁条,根本观察不到镁与氮气反应的现象,产物中也检验不出氮化镁.生成的氮化镁究竟“跑”到哪儿去了?于是,他对该问题进行了探究.
1、仪器、药品
仪器:水槽、钟罩(内径15厘米、容积约为2300毫升)、
药品:镁条、蒸馏水、红色石蕊试纸
2、仪器装置
3、步骤、现象
(1)如图1所示,将一蒸发皿浮于水面,通过燃烧的红磷除去钟罩内的氧气,待充分冷却,观察到钟罩内的水面上升了原水面上方容积的1/5,得到了较为纯净的氮气.
(2)往水槽内慢慢注水,使钟罩内外水面持平.
(3)在一单孔塞上固定一家用保鲜薄膜袋,另一端插入一粗铜丝,铜丝下端悬挂一约25厘米长绕成螺旋状的光亮的镁条.
(4)如图2所示,点燃镁条,同时拔出插有燃烧匙的塞子,立刻将燃烧着的镁条伸入钟罩内,并塞紧单孔塞.可观察到镁条与刚混入的少量氧气剧烈反应,冒出大量的白烟,发出耀眼的白光,放出的热使钟罩内的气体体积迅速膨胀,一会儿光的强度在减弱,变成了红光.
(5)燃烧停止后,钟罩内的水面立刻上升,上端的内壁出现淡黄色粉未(氮化镁
(6)打开单孔塞,移走钟罩,把蒸发皿内的灰分转移至小试管内,加入1毫升蒸馏水,在试管口平放一湿润的红色石蕊试纸,加热到沸腾,可观察到红色石蕊试纸变蓝,反应方程式为:Mg3N2+6H2O?3Mg(OH)2↓+2NH3↑.
认真阅读以上材料,并回答以下问题:
①小李老师在装置中选用的是小气球还是家用保鲜袋?理由是什么?
②用什么词代替符号②,可以对氮化镁出现在钟罩内壁上端的现象作出解释?
③实验步骤(2)中,为什么要“往水槽内慢慢注水,使钟罩内外水面持平”?
④有人认为“Mg3N2在800℃时可分解成Mg和N2,Mg燃烧的火焰温度高于800℃,那么即使有Mg3N2生成,生成的Mg3N2也会分解,即燃烧的最终产物是MgO”;有人在理论上计算出“在500℃时,生成氧化镁与氮化镁的质量之比为108:1”.那么,请你谈谈“在空气中直接点燃镁条,根本观察不到镁与氮气反应的现象,产物中也检验不出氮化镁”的原因.
 氮化镁“跑”到哪儿去了
氮化镁“跑”到哪儿去了
小李老师发现,在空气中直接点燃镁条,根本观察不到镁与氮气反应的现象,产物中也检验不出氮化镁.生成的氮化镁究竟“跑”到哪儿去了?于是,他对该问题进行了探究.
1、仪器、药品
仪器:水槽、钟罩(内径15厘米、容积约为2300毫升)、________、单孔塞、粗铜丝、小试管、蒸发皿(直径9.3厘米)
药品:镁条、蒸馏水、红色石蕊试纸
2、仪器装置
3、步骤、现象
(1)如图1所示,将一蒸发皿浮于水面,通过燃烧的红磷除去钟罩内的氧气,待充分冷却,观察到钟罩内的水面上升了原水面上方容积的1/5,得到了较为纯净的氮气.
(2)往水槽内慢慢注水,使钟罩内外水面持平.
(3)在一单孔塞上固定一家用保鲜薄膜袋,另一端插入一粗铜丝,铜丝下端悬挂一约25厘米长绕成螺旋状的光亮的镁条.
(4)如图2所示,点燃镁条,同时拔出插有燃烧匙的塞子,立刻将燃烧着的镁条伸入钟罩内,并塞紧单孔塞.可观察到镁条与刚混入的少量氧气剧烈反应,冒出大量的白烟,发出耀眼的白光,放出的热使钟罩内的气体体积迅速膨胀,一会儿光的强度在减弱,变成了红光.
(5)燃烧停止后,钟罩内的水面立刻上升,上端的内壁出现淡黄色粉未(氮化镁________所致).
(6)打开单孔塞,移走钟罩,把蒸发皿内的灰分转移至小试管内,加入1毫升蒸馏水,在试管口平放一湿润的红色石蕊试纸,加热到沸腾,可观察到红色石蕊试纸变蓝,反应方程式为:Mg3N2+6H2O?3Mg(OH)2↓+2NH3↑.
认真阅读以上材料,并回答以下问题:
①小李老师在装置中选用的是小气球还是家用保鲜袋?理由是什么?
②用什么词代替符号②,可以对氮化镁出现在钟罩内壁上端的现象作出解释?
③实验步骤(2)中,为什么要“往水槽内慢慢注水,使钟罩内外水面持平”?
④有人认为“Mg3N2在800℃时可分解成Mg和N2,Mg燃烧的火焰温度高于800℃,那么即使有Mg3N2生成,生成的Mg3N2也会分解,即燃烧的最终产物是MgO”;有人在理论上计算出“在500℃时,生成氧化镁与氮化镁的质量之比为108:1”.那么,请你谈谈“在空气中直接点燃镁条,根本观察不到镁与氮气反应的现象,产物中也检验不出氮化镁”的原因.
查看习题详情和答案>>
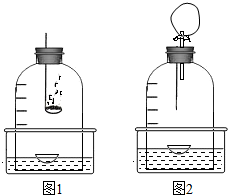
 测定空气中氧气含量的方法很多,图1所示的是用红磷在空气中燃烧的测定方法.实验过程是:
测定空气中氧气含量的方法很多,图1所示的是用红磷在空气中燃烧的测定方法.实验过程是:第一步:将集气瓶容积划分为五等份,并做好标记.
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的
| 1 |
| 5 |
请回答下列问题:
(1)红磷燃烧的文字表达式
磷+氧气
五氧化二磷
| 点燃 |
磷+氧气
五氧化二磷
,现象是| 点燃 |
剧烈燃烧,发黄光,产生大量白烟,放热
剧烈燃烧,发黄光,产生大量白烟,放热
,做完整个实验可得出的结论是氧气约占空气体积的五分之一
氧气约占空气体积的五分之一
.(2)实验完毕,若进入集气瓶中水的体积不到总容积的
| 1 |
| 5 |
气密性不好
气密性不好
、红磷不纯
红磷不纯
.(3)小明对实验进行反思后,提出了改进方法(如图2所示 ),你认为改进后的优点是
气密性好,可减小误差,防止生成的五氧化二磷逸散到空气中污染空气
气密性好,可减小误差,防止生成的五氧化二磷逸散到空气中污染空气
.(4)做完这个实验可以推导出氮气的物理性质
不溶于水
不溶于水
,氮气的化学性质化学性质比较稳定
化学性质比较稳定
.(各写一点)