网址:http://m.1010jiajiao.com/timu_id_4054096[举报]
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g) ![]() 2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
(2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-;![]() H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e- = PtF6- (g);![]() H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
O2PtF6 (s) = O2+ (g) + PtF6- (g);![]() H3= 482.2 kJ/mol
H3= 482.2 kJ/mol
则反应O2 (g) + PtF6 (g) = O2PtF6 (s);![]() H=_____________ kJ/mol。
H=_____________ kJ/mol。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
查看习题详情和答案>>(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g) 2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
(2)在一定温度和压强下,已知:
O2 (g) = O2+(g) + e-;![]() H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e-= PtF6- (g);![]() H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
O2PtF6 (s)= O2+ (g) + PtF6- (g); H3=482.2 kJ/mol
H3=482.2 kJ/mol
则反应O2 (g) + PtF6 (g) =O2PtF6 (s);![]() H=_____________ kJ/mol。
H=_____________ kJ/mol。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
查看习题详情和答案>>
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。 Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-; H1=" 1175.7" kJ/mol
H1=" 1175.7" kJ/mol PtF6 (g) + e- = PtF6- (g);
PtF6 (g) + e- = PtF6- (g); H2=" ―771.1" kJ/mol
H2=" ―771.1" kJ/mol O2PtF6 (s) = O2+ (g) + PtF6- (g);
O2PtF6 (s) = O2+ (g) + PtF6- (g);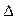 H3=" 482.2" kJ/mol
H3=" 482.2" kJ/mol 则反应O2 (g) + PtF6 (g) = O2PtF6(s);
则反应O2 (g) + PtF6 (g) = O2PtF6(s); H="_____________" kJ/mol。
H="_____________" kJ/mol。 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡
(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH
(填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡
(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH
(填“增大”、“减小”或“不改变”)。
 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+
(g) + e-;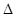 H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e-
= PtF6- (g);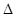 H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
 O2PtF6 (s)
= O2+ (g) + PtF6- (g);
O2PtF6 (s)
= O2+ (g) + PtF6- (g); H3=
482.2 kJ/mol
H3=
482.2 kJ/mol
则反应O2 (g) + PtF6 (g) =
O2PtF6 (s);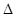 H=_____________ kJ/mol。
H=_____________ kJ/mol。
 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01
mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01
mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
查看习题详情和答案>>
(1)该反应中氧化剂是
(2)一定温度下,将1molCO和2molH2充入体积为2L的恒容密闭容器中,反应10min后达到平衡状态,测得CH4O(g)的物质的量为0.6mol,则0~10min内的平均速率v(H2)=
下列表示该反应过程的示意图正确的是
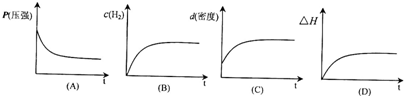
若开始在相同容积的密闭容器中充入2molCO和4molH2,则反应达到平衡后,CO的转化率与原平衡相比
(3)①甲醇催化氧化得甲酸(HCOOH),甲酸是一种弱酸.25℃时配制pH为1的甲酸溶液,若加水稀释10倍,则
| [HCOO-] | [HCOOH]?[OH-] |
A.一定增大 B.一定减小 C.不变 D.可能增大 E.可能减小
②若将pH=1的HCOOH溶液和pH=1的HCl溶液等体积混合,则混合过程中,电离平衡HCOOH?HCOO-+H+的变化趋势是
A.向右移动 B.向左移动 C.不移动 D.无法判断
判断的依据是