网址:http://m.1010jiajiao.com/timu_id_4053852[举报]

(1)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL 0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

①图中X、Y分别是
(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).
利用海水资源进行化工生产的部分工艺流程如图:

(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。

(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3•10H2O,Na2CO3•10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
查看习题详情和答案>>
利用海水资源进行化工生产的部分工艺流程如图: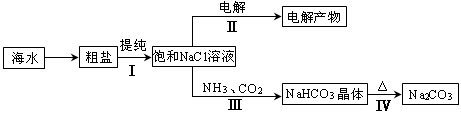
(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。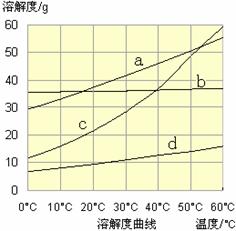
(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3?10H2O,Na2CO3?10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
海水占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”。也可以电解熔融氯化钠制得钠和氯气,该反应方程式为________________________。
(2)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下: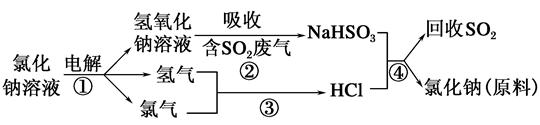
试写出反应的化学方程式:
②__________,③__________,④__________。
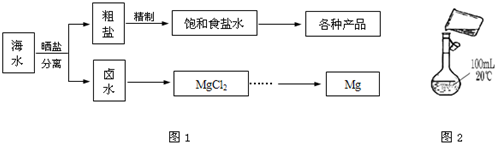
(1)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,图2是该同学转移溶液的示意图,图中有两点错误请指出:______
(2)用NaCl做原料可以得到多种产品.
实验室用惰性电极电解100mL 0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况,假设气体物质全部从溶液中逸出),则所得溶液的pH为______(忽略反应前后溶液的体积变化).
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图3所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
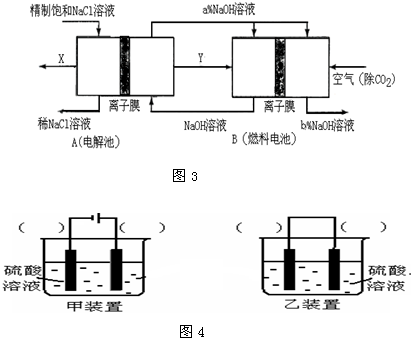
①图中X、Y分别是______、______(填化学式),②写出燃料电池B中正极发生的电极反应______;
(4)图4欲实现Cu+H2SO4═CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).