网址:http://m.1010jiajiao.com/timu_id_4047137[举报]
 A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:
A、B、C为原子序数依次递增的短周期元素,A元素原子的电子总数等于其基态电子层数,B元素原子的价电子结构为nsnnpn,C元素原子的第一电离能在同族元素中最大并且高于同周期左右相邻的元素,但其单质的熔点却低于同周期左右相邻元素的单质,D的价电子结构为3d64s2,请回答:(1)C与A形成的最简单分子是
(2 )在由A、B两元素形成的一系列化合物中,若要求所有的原子都有可能在同一个平面中,则对B原子成键轨道的要求是
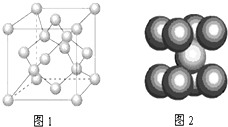
(3)一定条件下,元素B可形成多种同素异形体,它们有的属原子晶体、有的属分子晶体、有的属混合型晶体,如图1是其中某种晶体的一个晶胞,该晶胞中含有
(4)如图2为晶体D的晶胞结构,若D原子的半径为r cm,NA为阿伏加德罗常数的值,则晶体D的密度为
(20分)(1)在同一个原子中,离核越近、n越小的能层中的电子能量越 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子 的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
(2)写出下列基态原子的简化电子排布式:
①14Si ;②26Fe 。
(3)按所示格式填写下表中的空格:
| 原子序数 | 原子的价电子排布式 | 周期 | 族 |
| 17 | | 第三 | |
| | 3d54s1 | | ⅥB |
键更稳定(填“σ”或“π”)。
(5)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,配离子 [Cu(NH3)4]2+的配体是 。
(6)根据价层电子对互斥理论判断:
①NH3分子中,中心原子上的σ键电子对数为 ,孤电子对数为 ,价层电子对数为 ,中心原子的杂化方式为 杂化,VSEPR构型为 ,分子的立体构型为
 。
。②BF3分子中,中心原子的杂化方式为
 杂化,分子的立体构型为 。
查看习题详情和答案>>
杂化,分子的立体构型为 。
查看习题详情和答案>>
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W最外层电子数与电子层数相同,Y与X相邻,Y与Z也相邻;元素Z在地壳中含量最高。试回答下列各题:
(1)写出由其中两种元素组成的盐的电子式 。
(2)比较Y、Z离子半径大小 ( 用化学式表示)
(3)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,请写出反应物生成物均为10电子微粒的离子方程式_______________________________________。
(4)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A是日常生活中常用调味品的主要成分,且A与B能够反应生成C,C是一种有香味的液体。试写出该反应的化学方程式____________________________________________。
(5)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式_________________________。
(6)已知由元素X和Z可组成A、B、C、D四种中学化学中常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的物质的量之比为__________________________________。
查看习题详情和答案>>