摘要:3HCO3+Al3+=Al(OH)3↓+3CO2↑ 四.硅及其化合物的反应方程式 Si+2NaOH+H2O=Na2SiO3+2H2↑ Si+4HF=SiF4+2H2↑ SiO2+2NaOH=Na2SiO3+H2O SiO2+4HF=SiF4↑+2H2O Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3 五.硅及其化合物的特性 (1)硅的晶体是良好的半导体材料. (2)硅及其最高价氧化物SiO2的晶体为原子晶体. (3)硅虽是非金属.但可与氢氟酸作用置换出氢气. (4)硅可与强碱溶液反应生成H2.而其他非金属均不能发生此类反应. (5)二氧化硅为酸性氧化物.它不仅可与碱及碱性氧化物反应生成相应的盐.而且还可以与氢氟酸反应:SiO2+4HF=SiF4↑+2H2O. (6)硅酸盐是多种硅的盐的总称.而通常所说的某酸盐.为一种酸根的盐. (7)绝大多数非金属元素的最高价含氧酸只有一种.称为某酸.少数还可失水后生成偏某酸.而硅的+4价含氧酸有许多种.如H4SiO4.H2SiO3.H2Si2O5.H6Si2O7等. (8)Na2SiO3+CO2+2H2O=H4SiO4↓+Na2CO3该反应由于H2CO3的酸性比H4SiO4强而得以进行.但SiO2在高温下与Na2CO3反应生成Na2SiO3和CO2.Na2CO3+SiO2Na2SiO3+CO2↑.是CO2气体脱离反应体系才得以实现. 六.无机非金属材料分类 材 料 品种示例 传统无 机非金 属材料 水泥和其他胶凝材料 硅酸盐水泥.铝酸盐水泥.石灰.石膏等 陶 瓷 粘土质.长石质.滑石质和骨灰质陶瓷等 耐火材料 硅质.硅酸铝质.高铝质.镁质.铬镁质等 玻 璃 硅酸盐 搪 瓷 钢片.铸铁.铝和铜胎等 铸 石 辉绿岩.玄武岩.铸石等 研磨材料 氧化硅.氧化铝.碳化硅等 多孔材料 硅藻土.蛭石.沸石.多孔硅酸盐和硅酸铝等 碳素材料 石墨.焦炭和各种碳素制品等 非金属矿 粘土.石棉.石膏.云母.大理石.水晶和金刚石等 新型无 机非金 属材料 绝缘材料 氧化铝.氧化铍.滑石.镁橄榄石质陶瓷.石英玻璃和微晶玻璃等 铁电和压电材料 钛酸钡系.锆钛酸铅系材料等 磁性材料 锰-锌.镍-锌.锰-镁.锂-锰等铁氧体.磁记录和磁泡材料等 导体陶瓷 钠.锂.氧离子的快离子导体和碳化硅等 半导体陶瓷 钛酸钡.氧化锌.氧化锡.氧化钒.氧化锆等过滤金属元素氧化物系材料等 光学材料 钇铝石榴石激光材料.氧化铝.氧化钇透明材料和石英系或多组分玻璃的光导纤维等 高温结构陶瓷 高温氧化物.碳化物.氮化物及硼化物等难熔化合物 超硬材料 碳化钛.人造金刚石和立方氮化硼等 人工晶体 铝酸锂.钽酸锂.砷化镓.氟金云母等 生物陶瓷 长石质齿材.氧化铝.磷酸盐骨材和酶的载体材料等 无机复合材料 陶瓷基.金属基.碳素基的复合材料
网址:http://m.1010jiajiao.com/timu_id_4040086[举报]
铝是用途广泛的金属
(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)
A.NH3 B.CO2 C.NaOH D.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
(2)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:

①流程甲加入盐酸后生成Al3+的离子方程式为
②滤液E、K中溶质的主要成份是
查看习题详情和答案>>
(1)对金属制品进行抗腐蚀处理,可延长其使用寿命.以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是(用离子方程式表示)
2Al+2OH-+2H2O═2AlO+3H2↑
2Al+2OH-+2H2O═2AlO+3H2↑
.为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
b
.A.NH3 B.CO2 C.NaOH D.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
2Al+3H2O-6e-═Al2O3+6H+
2Al+3H2O-6e-═Al2O3+6H+
删除此空
删除此空
.取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的离子方程式是3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:

①流程甲加入盐酸后生成Al3+的离子方程式为
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.②滤液E、K中溶质的主要成份是
NaHCO3
NaHCO3
(填化学式),写出该溶液的一种用途制纯碱或做发酵粉等
制纯碱或做发酵粉等
.A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中A、D及C、F分别是同主族元素.A、F两元素的原子核中质子数之和比C、D两元素的原子核中质子数之和少2.F元素的最外层电子数是其次外层电子数的
.又知B元素的最外层电子数是内层电子数的2倍.E元素的最外层电子数等于其电子层数.请回答:
(1)写出元素A和B形成的直线型非极性分子的电子式:
 .
.
(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
(5)含有溶质为DAB2C4的水溶液显酸性的原因是
(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
查看习题详情和答案>>
| 3 |
| 4 |
(1)写出元素A和B形成的直线型非极性分子的电子式:


(2)已知:泡沫灭火器的工作原理是含有A、B、C、D四种元素形成的化合物X和含有C、E、F三种元素形成的Y的水溶液间的反应,写出该反应的离子方程式:
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
3HCO3-+Al3+═3CO2↑+Al(OH)3↓
.(3)工业上制备单质E,是通过电解C和E形成的化合物;写出阴极上的电极反应式:
Al3++3e-═Al
Al3++3e-═Al
.(4)1mol由E、F两种元素组成的化合物跟由A、C、D三种元素组成的化合物的溶液恰好完全反应,则消耗后者化合物的物质的量为
8
8
mol.(5)含有溶质为DAB2C4的水溶液显酸性的原因是
HC2O4-的电离大于水解
HC2O4-的电离大于水解
.(6)若G是周期表中第四周期第Ⅷ族的金属元素,其最高价氧化物与单质E反应的化学方程式是
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
(1)298K、100kPa时,C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1 2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1,请写出298K时由C(s,石墨)和H2(g)生成1molC2H2(g)的热化学方程式
(2)水是生命之源,也是化学反应中的主角.试回答下列问题:A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:
(3)写出硫化钠在水溶液中水解的离子方程式
(4)明矾可做净水剂是因为
(5)下列哪些事实能说明醋酸是弱酸
①醋酸不易腐蚀衣服;
②0.1mol/L的CH3COONa溶液的PH约为9;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多;
④0.1mol/L的CH3COOH溶液PH约为2.9;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量.
查看习题详情和答案>>
C(s,石墨)+H2(g)=C2H2(g)△H=226.7kJ?mol-1
C(s,石墨)+H2(g)=C2H2(g)△H=226.7kJ?mol-1
;(2)水是生命之源,也是化学反应中的主角.试回答下列问题:A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:
3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑
3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑
;(3)写出硫化钠在水溶液中水解的离子方程式
S2-+H2O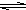 HS-+OH-
HS-+OH-
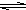 HS-+OH-
HS-+OH-S2-+H2O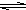 HS-+OH-
HS-+OH-
在配制硫化钠溶液时,为了防止发生水解,可以加入少量的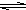 HS-+OH-
HS-+OH-NaOH
NaOH
;(4)明矾可做净水剂是因为
Al3+水解产生的胶状的Al(OH)3具有吸附性,可以吸附水中的杂质
Al3+水解产生的胶状的Al(OH)3具有吸附性,可以吸附水中的杂质
,有关的离子方程式为Al3++3H2O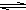 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生
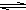 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生Al3++3H2O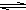 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生
;向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是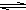 Al(OH)3+3H+有无色气体和白色絮状沉淀产生
Al(OH)3+3H+有无色气体和白色絮状沉淀产生有无色气体和白色絮状沉淀产生
有无色气体和白色絮状沉淀产生
,有关的离子方程式3HCO3-+Al3+=Al(OH)3↓+CO2↑
3HCO3-+Al3+=Al(OH)3↓+CO2↑
;(5)下列哪些事实能说明醋酸是弱酸
②④⑤⑥
②④⑤⑥
①醋酸不易腐蚀衣服;
②0.1mol/L的CH3COONa溶液的PH约为9;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多;
④0.1mol/L的CH3COOH溶液PH约为2.9;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量.
(1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
(3)已知[Ksp(AgBr)]=5.4×10-13,[Ksp(AgCl)]=2.0×10-10.向浓度均为0.1mol?L-1的KBr、NaCl混合溶液中滴入0.1mol?L-1的AgNO3溶液,首先生成的沉淀是
查看习题详情和答案>>
Al2O3
Al2O3
,Al2(SO4)3溶液蒸干最后得到的固体产物是Al2(SO4)3
Al2(SO4)3
;(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
3HCO3-+Al3+═Al(OH)3↓+3CO2↑
.(3)已知[Ksp(AgBr)]=5.4×10-13,[Ksp(AgCl)]=2.0×10-10.向浓度均为0.1mol?L-1的KBr、NaCl混合溶液中滴入0.1mol?L-1的AgNO3溶液,首先生成的沉淀是
AgBr
AgBr
.当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=2.7×10-3
2.7×10-3
.A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大.元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多1,B、C、F的原子序数之和等于E、G的原子序数之和.请回答下列问题:
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为
(3)由A、B、C、D四种元素组成的一种常见化合物的溶液分别与由C、D、E三种元素组成的一种化合物的溶液和由E、G两种元素组成的一种化合物的溶液都能反应得到同一种白色沉淀,写出上述两个反应的离子方程式:
(4)用B、E两种元素的单质作为电极材料,A、C、D三种元素组成的化合物的水溶液作为电解质溶液可组成原电池.则原电池的负极为
(5)由A、B、C三种元素可形成许多种化合物,其中一种化合物的化学式为A2B2C4,这种化合物的水溶液100mL 2mol/L与100mL 1mol/L由A、C、D三种元素形成的化合物的水溶液反应,所得溶液呈酸性,其原因为
查看习题详情和答案>>
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
SO2、Na2O2、HClO、NaClO
SO2、Na2O2、HClO、NaClO
(至少写出4种).(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为
H2O>HCl>CH4
H2O>HCl>CH4
(用化学式表示).(3)由A、B、C、D四种元素组成的一种常见化合物的溶液分别与由C、D、E三种元素组成的一种化合物的溶液和由E、G两种元素组成的一种化合物的溶液都能反应得到同一种白色沉淀,写出上述两个反应的离子方程式:
HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
、3HCO3-+Al3+=Al(OH)3↓+3CO2↑
3HCO3-+Al3+=Al(OH)3↓+3CO2↑
.(4)用B、E两种元素的单质作为电极材料,A、C、D三种元素组成的化合物的水溶液作为电解质溶液可组成原电池.则原电池的负极为
铝
铝
(填名称),其负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O
Al-3e-+4OH-=AlO2-+2H2O
.(5)由A、B、C三种元素可形成许多种化合物,其中一种化合物的化学式为A2B2C4,这种化合物的水溶液100mL 2mol/L与100mL 1mol/L由A、C、D三种元素形成的化合物的水溶液反应,所得溶液呈酸性,其原因为
NaHC2O4溶液中HC2O4-的电离程度大于其水解程度,故其溶液呈酸性
NaHC2O4溶液中HC2O4-的电离程度大于其水解程度,故其溶液呈酸性
,所得溶液中各种离子的物质的量浓度的大小关系为c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
.