摘要:76.硫酸铜晶体受热分解:CuSO4·5H2O 加热 CuSO4 + 5H2O
网址:http://m.1010jiajiao.com/timu_id_4030848[举报]
胆矾(CuSO4?5H2O)是重要的化工原料,工业上用Cu与浓H2SO4、浓HNO3反应制备该物质,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O的新工艺.模拟制备装置如图所示,根据题意回答下列问题.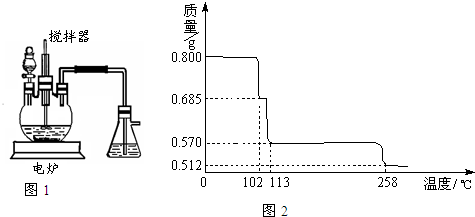
(1)如图1装置中,分液漏斗内装的液体是
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4?5H2O中常常含有的杂质是一种硝酸盐,其化学式是
(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是
(4)将0.80g CuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.
①由图2中可以看出,CuSO4?5H2O分解的最低温度是
②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4?5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为
查看习题详情和答案>>

(1)如图1装置中,分液漏斗内装的液体是
浓硝酸
浓硝酸
(填“浓硝酸”或“浓硫酸”),该发应会产生有毒气体NO、NO2等,锥形瓶中液体可以吸收该气体,反应原理为:NO+NO2+2NaOH=2NaNO2(该物质化学名是亚硝酸钠
亚硝酸钠
)+H2O.该装置中搅拌器的作用是充分接触,加快反应速率
充分接触,加快反应速率
.反应所得产品在三颈烧瓶
三颈烧瓶
(填“三颈烧瓶”或“锥形瓶”)中.(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4?5H2O中常常含有的杂质是一种硝酸盐,其化学式是
Cu(NO3)2
Cu(NO3)2
,已知10℃、20℃时有关物质的溶解度为:CuSO4?5H2O(17.4g、20.7g);该硝酸盐(95.3g、125.1g),提纯CuSO4?5H2O的实验操作是重结晶(或冷却结晶)
重结晶(或冷却结晶)
.(3)用无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此现象你的猜想是
铜离子作催化剂,双氧水分解出氧气
铜离子作催化剂,双氧水分解出氧气
,检验该气体的实验操作是用带火星木条检验,看是否复燃
用带火星木条检验,看是否复燃
.(4)将0.80g CuSO4?5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图2所示.
①由图2中可以看出,CuSO4?5H2O分解的最低温度是
102℃
102℃
.②试通过计算确定238℃时固体物质的化学式.(要计算过程)
③将CuSO4?5H2O固体加热到570℃分解后,得到的主要产物是黑色粉末、硫的最高价氧化物和水蒸气,该反应的化学方程式为
CuSO4?5H2O
CuO+SO3↑+5H2O↑
| ||
CuSO4?5H2O
CuO+SO3↑+5H2O↑
.
| ||
 氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜固体(含硫酸亚铁等杂质)进行如下实验:
氧化铜有多种用途,如作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜固体(含硫酸亚铁等杂质)进行如下实验:(1)制备氧化铜:工业CuSO4
| Ⅰ |
| Ⅱ |
| Ⅲ |
①步骤Ⅰ的目的是除去不溶性杂质.步骤Ⅰ的操作是:
加适量的水溶解、搅拌、过滤
加适量的水溶解、搅拌、过滤
.②步骤Ⅱ的目的是除铁.
③步骤Ⅲ的目的是得到CuSO4?5H2O晶体,操作是:
将CuSO4溶液加热蒸发至有晶体析出现时,停止加热
将CuSO4溶液加热蒸发至有晶体析出现时,停止加热
、过滤、水浴加热烘干(水浴加热的特点是受热均匀,温度易于控制在100℃以下)④制备氧化铜(略)
(2)探究氧化铜的性质
①取A、B两支试管,往A中加入适量的CuO粉末,再分别向A和B加入等体积3%H2O2溶液,只观察到A中有大量气泡,结论是:
CuO可加快过氧化氢分解的反应速率,是过氧化氢分解反应的催化剂
CuO可加快过氧化氢分解的反应速率,是过氧化氢分解反应的催化剂
②为探究试管A中的反应速率(单位以mL/s表示),用如图所示装置收集气体并测定其体积,实验中还必需用到的仪器是:
计时器
计时器
. 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:Ⅰ、硫酸铜的制备
(1)某学习小组同学利用铜屑、稀硫酸为原料制备硫酸铜.其原理是在高温条件下将铜粉反复灼烧,使铜充分氧化成氧化铜,再将氧化铜与稀硫酸反应制备硫酸铜,请写出相应的化学方程式
2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
、
| ||
CuO+H2SO4=CuSO4+H2O
CuO+H2SO4=CuSO4+H2O
;(2)通过查阅资料,同学们找到了一种工业制备硫酸铜晶体(CuSO4?xH2O)的流程,具体如下:将铜丝放到稀硫酸中,控温在50℃.加入10%的H2O2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发、降温结晶等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O.
①写出该工艺流程生成CuSO4的化学方程式
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
;②在上述生产过程中,控制温度在50℃和60℃加热的原因为
防止H2O2受热分解
防止H2O2受热分解
,③上述生产流程的优点有
耗能少
耗能少
(写出一种即可);④在过滤时,采用了右图所示的装置,你认为这样做的优点是
加快过滤的速度
加快过滤的速度
;Ⅱ、硫酸铜的应用及相关实验
(1)波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为
+2价
+2价
,该化学式可以写成盐和碱的形式CuSO4?3Cu(OH)2
CuSO4?3Cu(OH)2
,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是蛋白质
蛋白质
(填一种有机物名称).(2)为验证Al的化学性质比铜活泼,小怡做了以下实验,现象如下表:
| Al片(未打磨) | Al片(打磨) | |
| CuSO4溶液 (5%,5mL) |
无变化,数小时后铝片上附有极少气泡,几乎无红色物质 | 极少气泡,附着极少红色物质,持续较长时间 |
| CuSO4溶液 (10%,5mL) |
无变化,数小时后铝片附有稍多气泡,仅有极少红色斑点 | 稍多气泡,附着极少(多于5%)红色物质,持续较长时间 |
| CuCl2溶液 (5%,5mL) |
多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 | 更多量气泡,迅速出现红色物质,很快溶液变成无色,且温度升高 |
①铝和铜盐溶液反应速率与
铝片是否打磨
铝片是否打磨
、硫酸铜溶液的浓度
硫酸铜溶液的浓度
和不同的铜盐
不同的铜盐
有关,同时说明铜盐溶液中的Cl-能加快
加快
(填“加快”或“抑制”)反应速率,若实验室没有CuCl2溶液,则可以在CuSO4溶液中加入少许盐酸
盐酸
(填物质名称),以使实验现象更为明显;②该反应过程要
放热
放热
(填“吸热”或“放热”).经检验,产生的气体是一种能燃烧的单质,该气体是H2
H2
(填化学式);Ⅲ、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定
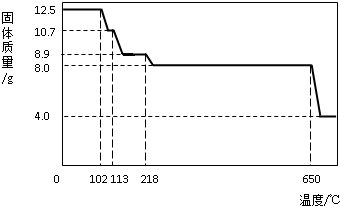
在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,获得相关数据,并绘制成固体质量-温度的关系如下图.
(1)在加热过程中,随着水分的蒸发,固体颜色将由蓝色逐渐变为
白
白
色,最终变为黑色;(2)写出固体质量由10.7g变为8.9g时的化学方程式
CuSO4?xH2O
CuSO4+xH2O↑
| ||
CuSO4?xH2O
CuSO4+xH2O↑
;
| ||
(3)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为
2CuSO4
2CuO+2SO2↑+O2↑
| ||
2CuSO4
2CuO+2SO2↑+O2↑
;
| ||
(4)根据图中数据,计算CuSO4?xH2O中的CuSO4的质量分数.(要求:根据x的值进行计算,CuSO4的相对分子质量:160,H2O的相对分子质量:18)