摘要:硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
网址:http://m.1010jiajiao.com/timu_id_4030826[举报]
(2012?湘潭)在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(常温下)他们先测定出某NaOH溶液的pH
结论:稀H2SO4与NaOH溶液发生了化学反应,并且
(2)方案二:利用酸碱指示剂
①探究稀H2SO4与NaOH溶液的反应
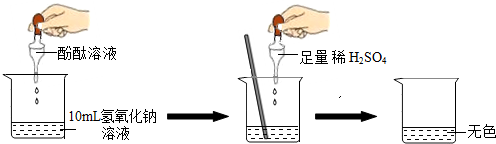
如图所示进行实验.当滴入几滴酚酞溶液后,溶液由无色变为
②探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2溶液与、紫色石蕊溶液、Na2CO3粉末设计实验方案,请你判断并分析:
方案三中反应的化学方程式为
查看习题详情和答案>>
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(常温下)他们先测定出某NaOH溶液的pH
大于
大于
7(填“大于”、“等于”或“小于”),然后将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后再测定其pH,发现其pH小于7.结论:稀H2SO4与NaOH溶液发生了化学反应,并且
稀硫酸
稀硫酸
过量.(2)方案二:利用酸碱指示剂
①探究稀H2SO4与NaOH溶液的反应

如图所示进行实验.当滴入几滴酚酞溶液后,溶液由无色变为
红
红
色.根据上述过程中的颜色变化,确定稀H2SO4与NaOH溶液发生了反应,该反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
.②探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量
根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2溶液与、紫色石蕊溶液、Na2CO3粉末设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
| 方案三 | 取样,加入Na2CO3粉末 | 有气体产生 | 稀H2SO4过量 |
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
.上述设计的实验方案中,不正确的是方案一
方案一
(填“方案一”、“方案二”或“方案三”).错误的原因是即使硫酸不过量,先前生成的硫酸钠也能和氯化钡反应生成白色沉淀
即使硫酸不过量,先前生成的硫酸钠也能和氯化钡反应生成白色沉淀
.请你再设计一个实验方案确定稀H2SO4是否过量,你选用加入氧化铜,观察溶液的颜色变化,若显示为蓝色,则硫酸过量
加入氧化铜,观察溶液的颜色变化,若显示为蓝色,则硫酸过量
(填药品或者方法).(2013?汉沽区一模)在研究酸和碱的化学性质时,某小组想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案设计、实施和评价.
①探究稀H2SO4与NaOH溶液的反应

当滴入几滴酚酞溶液后,溶液由无色变为
②探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量,根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并分析:
上述设计的实验方案中,正确的是
另外一个实验方案错误的原因是:
请你再设计一个实验方案确定稀H2SO4过量,你选用
查看习题详情和答案>>
①探究稀H2SO4与NaOH溶液的反应

当滴入几滴酚酞溶液后,溶液由无色变为
红
红
色.根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应.反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.②探究上述稀H2SO4与NaOH溶液反应后烧杯中的硫酸是否过量,根据上述反应过程中溶液变成无色,不能确定稀H2SO4是否过量,同学们又分别选取BaCl2、紫色石蕊溶液设计实验方案,请你判断并分析:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的BaCl2溶液 | 出现白色沉淀 | 稀H2SO4过量 |
| 方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀H2SO4过量 |
方案二
方案二
(选填:方案一、方案二).另外一个实验方案错误的原因是:
方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀
方案一错误的原因是溶液中有生成的硫酸钠,加入氯化钡溶液同样产生白色沉淀
.请你再设计一个实验方案确定稀H2SO4过量,你选用
锌粒
锌粒
(药品或者方法). (2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气
(2011?和平区二模)某同学为了检验家里购买的硫酸铵化肥是否合格,他称取27.5g化肥样品与足量浓烧碱溶液加热,产生的氮气用100.0g废硫酸吸收.测得吸收氨气的溶液总质量m与反应时间t的变化如图所示,所涉及的反应为:(NH4)SO4+2NaOH=Na2SO4+2NH3+2H2O↑;2NH3+H2SO4=(NH4)SO4.请计算:(1)完全反应后产生氨气6.8
6.8
g(2)该化肥的含氨量为
20.4%
20.4%
(精确到0.1%),则这种化肥属于合格
合格
(填“合格”或“不合格”,合格硫酸铵含氮量为20%以上)产品.(3)请计算废硫酸中硫酸的质量分数(写出计算过程)
(2010?永州)某同学取一定量久置于空气中的固体烧碱样品(其中只含有NaOH和Na2CO3)溶于适量水中,向其中加入足量的稀H2SO4溶液,充分搅拌到不再产生气泡为止,测得放出CO2气体的质量为2.2g.请回答:
(1)写出上述样品中物质与稀H2SO4溶液发生反应的化学方程式①
(2)若上述所取样品的质量为20g,计算样品中NaOH的质量分数(写出详细的计算过程)
(3)若取质量相等的固体烧碱两份,甲份密封处理,乙份露置空气一段时间使其部分变质,然后将它们分别溶于水,并与相同浓度的稀硫酸充分反应,则消耗稀硫酸溶液的体积比较:V(甲)
查看习题详情和答案>>
(1)写出上述样品中物质与稀H2SO4溶液发生反应的化学方程式①
2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
、②Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
.(2)若上述所取样品的质量为20g,计算样品中NaOH的质量分数(写出详细的计算过程)
(3)若取质量相等的固体烧碱两份,甲份密封处理,乙份露置空气一段时间使其部分变质,然后将它们分别溶于水,并与相同浓度的稀硫酸充分反应,则消耗稀硫酸溶液的体积比较:V(甲)
=
=
V(乙)(填“=““>“或“<”). 21、化学兴趣小组的同学用如图所示装置进行中和反应实验,请你参与下列探究:
21、化学兴趣小组的同学用如图所示装置进行中和反应实验,请你参与下列探究:(1)为确定稀硫酸与氢氧化钠溶液是否刚好完全中和,小华取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论.
a.写出该反应的化学方程式:
2NaOH+H2SO4═Na2SO4+2H2O
,该反应的基本类型属于复分解反应
(选填“化合”、“分解”、“置换”或“复分解”)反应.b.小亮认为小华得出的结论不完整,他认为除了“恰好中和”外,还有第二种可能性,这种可能性是
硫酸过量
.c.请你另外设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:

(2)玲玲同学在实验时,发现烧杯中有少量的气泡产生,她经过分析认为可能的原因是氢氧化钠溶液变质.
a.你认为氢氧化钠溶液变质的原因是由于氢氧化钠与空气中的
二氧化碳
发生化学反应生成了碳酸钠.因此实验室应密封
保存氢氧化钠.b.为了检验氢氧化钠溶液是否变质,玲玲提出用酚酞试液检验,你认为该方法
不正确
(选填“正确”或“不正确”),理由是碳酸钠溶液也显碱性.
.c.如果氢氧化钠溶液已经变质,下列试剂可用来除去碳酸钠的是
B
(填序号).A.稀盐酸;B.氢氧化钙溶液;C.氯化钙溶液;D.氯化钠溶液
(3)中和反应在实际生产、生活中有着极为广泛的应用,请你举一具体实例加以说明:
用熟石灰来中和酸性土壤.
.