摘要: 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
网址:http://m.1010jiajiao.com/timu_id_4030823[举报]
 14、过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物 ( 用X表示 );也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑.以下是某兴趣小组进行的探究活动.
14、过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物 ( 用X表示 );也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑.以下是某兴趣小组进行的探究活动.(1)利用如图所示实验装置制取氧气,请回答有关问题.
①实验室制取CO2的化学方程式为
CaC03+2HCl=CaCl2+H20+C02↑
.②表明CO2未被Na2O2完全吸收的现象为
澄清石灰水变浑浊
.③O2可采用D装置收集,并用带火星的木条检验,利用了O2的
氧气密度比空气的大,氧气有助燃性
性质.④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,
以上实验装置必须加以改进,则改进的方法是
在A、B装置之间(或B、C装置之间)增加气体干燥装置
.(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
【提出猜想】猜想Ⅰ:X是一种酸; 猜想Ⅱ:X是一种碱; 猜想Ⅲ:X是Na2CO3
【分析讨论】通过对物质组成的分析,一致认为猜想Ⅰ和猜想Ⅱ均不合理.理由是
Na202和C02都不含氢元素,二者反应后不可能生成含氢元素的酸或碱
【实验探究】同学们为证明猜想Ⅲ,设计了如下的两个实验方案,请将下表填写完整.
| 实验操作 | 现 象 | 有关反应的化学方程式 |
| 方案一:取少量固体样品于试 管中,向其中 滴加稀盐酸,将气体通入澄清石灰水 . |
有气泡产生 ,澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ C02+Ca(OH)2=CaC03↓+H2O |
| 方案二:取少量固体,加水配 成溶液,滴加适量 氯化钙或氯化钡等 溶液 |
有白色沉淀产生 | Na2C03+CaCl2=CaC03↓+2NaCl 或Na2C03+BaCl2=BaC03↓+2NaCl等 |
 实验室用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊.为此,同学们进行了探究.
实验室用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊.为此,同学们进行了探究.[提出猜想]甲同学认为:澄清石灰水已变质; 乙同学认为:气体X中不只含有CO2;
[实验方案]
(1)甲的探究:①取稀硫酸与碳酸钠反应制取CO2;反应的方程式为
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
,将生成的气体通入澄清石灰水.现象为
澄清的石灰水变浑浊
澄清的石灰水变浑浊
.实验结论:澄清石灰水没有变质.
(2)乙的探究:用盐酸和碳酸钙固体反应,将得到的气体X通入硝酸银溶液.
实验现象
有白色沉淀生成
有白色沉淀生成
;实验结论:气体X中还有
HCl
HCl
气体.根据实验结论,用化学方程式表示石灰水未变浑浊的原因CaCO3+2HCl=CaCl2+CO2↑+H2O;Ca(OH)2+2HCl=CaCl2+2H2O
CaCO3+2HCl=CaCl2+CO2↑+H2O;Ca(OH)2+2HCl=CaCl2+2H2O
.[分析与讨论]
(3)在讨论中,丙同学提出:只用图25实验装置就可以同时完成上述两个假设的探究.则A、B试管中的试剂依次是下列选项中的
②
②
.①浓硫酸、硝酸银溶液
②饱和碳酸氢钠溶液、硝酸银溶液
③硝酸银溶液、石蕊溶液
④氢氧化钠溶液、硝酸银溶液
(4)B试管中试剂的作用是
检验HCl是否除尽
检验HCl是否除尽
.(2006?泰安)小明在“探究盐酸和氢氧化钙能否发生化学反应”时,设计了如图所示的对照实验: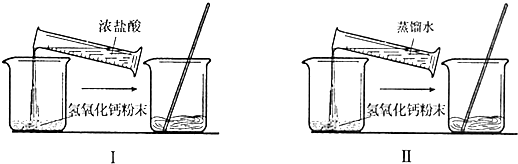
他设想在室温下,先取少量氢氧化钙粉末分别放入两只烧杯中,在Ⅱ烧杯中加入一定量的蒸馏水,在I烧杯中加入含等量蒸馏水的浓盐酸,充分搅拌,一段时间后,观察现象.
根据上述情况,请回答以下问题:
(1)你认为要得到可靠的实验结论,需要保证实验I、Ⅱ中
(2)设计对照实验Ⅱ的目的是
(3)如果不采用对照实验,请你设计一个简单实验证明盐酸和氢氧化钙能够发生化学反应:
(4)写出该反应的化学方程式
查看习题详情和答案>>

他设想在室温下,先取少量氢氧化钙粉末分别放入两只烧杯中,在Ⅱ烧杯中加入一定量的蒸馏水,在I烧杯中加入含等量蒸馏水的浓盐酸,充分搅拌,一段时间后,观察现象.
根据上述情况,请回答以下问题:
(1)你认为要得到可靠的实验结论,需要保证实验I、Ⅱ中
氢氧化钙粉末的质量
氢氧化钙粉末的质量
完全相同.预测通过观察实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小)
实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小)
的现象,说明盐酸和氢氧化钙发生了化学反应;(2)设计对照实验Ⅱ的目的是
排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应
排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应
;(3)如果不采用对照实验,请你设计一个简单实验证明盐酸和氢氧化钙能够发生化学反应:
在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应
在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应
;(4)写出该反应的化学方程式
Ca(OH)2+2HCl=CaCl2+2H20
Ca(OH)2+2HCl=CaCl2+2H20
.(2013?贵阳)某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究.请你参与.
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和Ca(OH)2;猜想三,有CaCl2和HCl.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
[实验结论]丙认为猜想三正确.
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
查看习题详情和答案>>
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由
红
红
色变为无色.结论:两种物质发生了反应.反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和Ca(OH)2;猜想三,有CaCl2和HCl.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) | 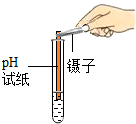 |
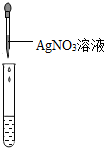 |
 |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是
方案1中使用pH试纸的操作不对;方案2中加AgNO3产生白色沉淀说明溶液中有Cl-,不能说明只有氯化钙
方案1中使用pH试纸的操作不对;方案2中加AgNO3产生白色沉淀说明溶液中有Cl-,不能说明只有氯化钙
.大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为
先有气体产生,后有白色沉淀生成
先有气体产生,后有白色沉淀生成
.[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
| 要分离的盐 | 所用试剂 | 主要操作 |
CaCl2、NaCl CaCl2、NaCl |
Na2CO3,HCl Na2CO3,HCl |
混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 |
 某化学实验小组欲探究盐酸、氢氧化钙两种物质的化学性质,取8支试管分别用A~H编号后,做如下实验.
某化学实验小组欲探究盐酸、氢氧化钙两种物质的化学性质,取8支试管分别用A~H编号后,做如下实验.(1)实验中观察到有气泡出现的试管是
B D
B D
,有沉淀生成的试管是G H
G H
.(2)写出实验中无明显现象产生的试管中发生反应的化学方程式:
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+2HCl=CaCl2+2H2O
.(3)实验后某试管中为红色溶液,当向其中加入过量的
NaOH溶液
NaOH溶液
后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是紫色石蕊溶液
紫色石蕊溶液
.(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是
NaOH和Na2CO3
NaOH和Na2CO3
.(5)第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色.为此得出溶液中一定不含有的溶质是
HCl
HCl
(填写化学式,下同),一定含有的溶质是NaCl NaOH
NaCl NaOH
.(6)通过上述实验,可归纳出盐酸的化学性质有
与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
.