摘要: 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
网址:http://m.1010jiajiao.com/timu_id_4030802[举报]
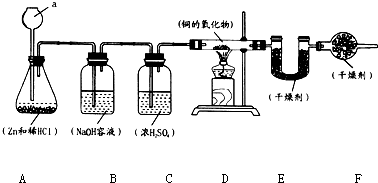 实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:
实验室用锌和稀盐酸制取氢气,并用氢气还原铜的一种氧化物的实验来测定该氧化物的组成.实验装置如图所示:试回答下列问题:
(1)仪器a的名称是
长颈漏斗
长颈漏斗
,a仪器下端管口插入液面下的目的是防止生成的氢气从长颈漏斗口逸出
防止生成的氢气从长颈漏斗口逸出
.(2)B、C、F装置的作用分别是:B
除去氢气中的氯化氢气体
除去氢气中的氯化氢气体
,C除去氢气中的水蒸气
除去氢气中的水蒸气
,F吸收空气中的水蒸气,防止进入E装置
吸收空气中的水蒸气,防止进入E装置
.(3)在点燃D装置中酒精灯以前,要将氢气通过整个装置一段时间的目的是
排除整个装置内的空气,防止加热时发生爆炸
排除整个装置内的空气,防止加热时发生爆炸
.(4)A中产生的现象是
产生大量气泡,锌粒逐渐溶解
产生大量气泡,锌粒逐渐溶解
,反应的化学方程式是Zn+2HCl=ZnCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
.(5)已知D装置中铜的氧化物的质量为7.2g,当其完全被还原时,称得E装置增重0.9g,则这种铜的氧化物中铜元素和氧元素的质量比的原始计算式为
7.2g-0.9g×
| ||
0.9g×
|
7.2g-0.9g×
| ||
0.9g×
|
Cu2O
Cu2O
.(6)如果B、C装置的顺序颠倒,将造成铜、氧两元素的质量之偏
低
低
(填“高”或“低”),原因是B装置中的水蒸气会随气流进入E装置,使测出水的质量增加,从而导致由水计算出的氧元素的质量增大,铜元素质量减少,最终导致结果偏低
B装置中的水蒸气会随气流进入E装置,使测出水的质量增加,从而导致由水计算出的氧元素的质量增大,铜元素质量减少,最终导致结果偏低
.写出下列反应的化学方程式
(1)锌与稀盐酸反应
(2)碳和氧化铜反应
(3)生成两种沉淀的反应
查看习题详情和答案>>
(1)锌与稀盐酸反应
Zn+2HCl═ZnCl2+H2↑
Zn+2HCl═ZnCl2+H2↑
(2)碳和氧化铜反应
C+2CuO
2Cu+CO2↑
| ||
C+2CuO
2Cu+CO2↑
| ||
(3)生成两种沉淀的反应
CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓
CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓
.阅读下列资料,完成本题
1766年,英国化学家卡文迪许用金属锌和稀盐酸制得氢气,并把氢气收集到一个倒置在水槽中的装满水的瓶中.最初,氢气被用于飞艇和载人气球.1937年“兴登堡”号飞艇因为火花引起燃烧,从此,人们改用氦气填充飞艇.工业上氢气主要用来和氮气反应制取氨气(NH3);还可以用来制备金属,如三氧化钨和氢气加热得到水和金属钨.氢气燃烧时放出大量热,是等质量汽油燃烧放热的3倍;氢气燃烧后的产物是水,不会造成污染,因此,氢气正在成为新兴的能源.工业上,人们常用水和高温的焦炭(C)反应制得一氧化碳和氢气.
(1)物质的性质决定物质的应用,本文中介绍了一些氢气的应用知识,请写出相对应的氢气性质.(用文字表述)用倒置在水槽中的装满水的瓶子收集氢气:
(2)文中分别介绍了一种氢气的实验室制法和工业制法,请写出相应的化学方程式.工业:
(3)配平下列反应化学方程式
①N2+H2
NH3
②WO3+H2
W+H2O.
查看习题详情和答案>>
1766年,英国化学家卡文迪许用金属锌和稀盐酸制得氢气,并把氢气收集到一个倒置在水槽中的装满水的瓶中.最初,氢气被用于飞艇和载人气球.1937年“兴登堡”号飞艇因为火花引起燃烧,从此,人们改用氦气填充飞艇.工业上氢气主要用来和氮气反应制取氨气(NH3);还可以用来制备金属,如三氧化钨和氢气加热得到水和金属钨.氢气燃烧时放出大量热,是等质量汽油燃烧放热的3倍;氢气燃烧后的产物是水,不会造成污染,因此,氢气正在成为新兴的能源.工业上,人们常用水和高温的焦炭(C)反应制得一氧化碳和氢气.
(1)物质的性质决定物质的应用,本文中介绍了一些氢气的应用知识,请写出相对应的氢气性质.(用文字表述)用倒置在水槽中的装满水的瓶子收集氢气:
用倒置在水槽中的装满水的瓶子收集氢气--氢气难溶于水
用倒置在水槽中的装满水的瓶子收集氢气--氢气难溶于水
;氢气被用于飞艇和载人气球:氢气被用于飞艇和载人气球--氢气的密度比空气小
氢气被用于飞艇和载人气球--氢气的密度比空气小
;氢气正在成为新兴的能源:氢气正在成为新兴的能源--氢气可燃
氢气正在成为新兴的能源--氢气可燃
.(2)文中分别介绍了一种氢气的实验室制法和工业制法,请写出相应的化学方程式.工业:
C+H2O
CO+H2
| ||
C+H2O
CO+H2
;实验室:
| ||
Zn+2HCl=ZnCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
.(3)配平下列反应化学方程式
①N2+H2
| 催化剂 |
| 加热、加压 |
②WO3+H2
| 高温 |
某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究.
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙.但其中是否含有盐酸(含有H+),需要通过实验来证明.
【查阅资料】碳酸钙不溶于水,氯化钙溶液呈中性.
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温.
查看习题详情和答案>>
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙.但其中是否含有盐酸(含有H+),需要通过实验来证明.
【查阅资料】碳酸钙不溶于水,氯化钙溶液呈中性.
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温.
| 实验操作 | 实验现象 | 实验结论 | |
| 甲同学 | 取烧杯中溶液少许于试管中,向其中滴加 紫色石蕊试液 紫色石蕊试液 |
现象:溶液变为红色 |
溶液含有盐酸(含有H+) |
| 乙同学 | 取烧杯中溶液少许于试管中,向其中加入少量锌粒 | 现象: 锌粒逐渐溶解,有气泡产生 锌粒逐渐溶解,有气泡产生 ;反应的化学方程式是:Zn+2HCl=ZnCl2+H2↑ Zn+2HCl=ZnCl2+H2↑ | |
| 丙同学 | 取烧杯中溶液少许于试管中,向其中加入少量石灰石 | 现象: 石灰石逐渐溶解,有气泡产生 石灰石逐渐溶解,有气泡产生 ;反应的化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑ CaCO3+2HCl═CaCl2+H2O+CO2↑ |