摘要: 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
网址:http://m.1010jiajiao.com/timu_id_4030799[举报]
4、实验室制取氢气常用的药品是
查看习题详情和答案>>
锌和稀硫酸
,反应现象是
锌片质量减少、有气泡产生
,反应方程式为
Zn+H2SO4=ZnSO4+H2↑
;还可用
稀盐酸
代替稀硫酸,用
铁
和
锡
代替锌,反应分别表示为
Fe+H2SO4=FeSO4+H2↑
和
Sn+H2SO4=SnSO4+H2↑
.(2010?衡阳)化学实验室的开放日,张红同学利用铁、稀硫酸、碳酸氢钠、氯酸钾四种试剂(催化剂和仪器可任选),依次完成下列顺序的四种基本反应类型的反应,请你写出其对应的化学方程式.
(1)分解反应:
(2)化合反应:
(3)置换反应:
(4)复分解反应:
查看习题详情和答案>>
(1)分解反应:
2KCl03
2KCl+3O2↑
| ||
2KCl03
2KCl+3O2↑
.
| ||
(2)化合反应:
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
(3)置换反应:
Fe+H2SO4═FeSO4+H2↑(或Fe3O4+4H2═3Fe+4H2O)
Fe+H2SO4═FeSO4+H2↑(或Fe3O4+4H2═3Fe+4H2O)
.(4)复分解反应:
2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑
2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑
.完成下列反应的化学方程式.
(1)实验室用锌与稀硫酸反应制取:
(2)二氧化碳和澄清的石灰水的反应:
(3)铁与硫酸铜反应:
查看习题详情和答案>>
(1)实验室用锌与稀硫酸反应制取:
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
.(2)二氧化碳和澄清的石灰水的反应:
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.(3)铁与硫酸铜反应:
Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
. 小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫 酸在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:
小明同学学了质量守恒定律后,自己查资料得知铁粉和稀硫 酸在常温下可反应生成硫酸亚铁和氢气,于是他设计了如图所示的实验,探究物质发生化学变化的前后,总质量是否发生了改变?请你和小明按下面的过程一起探究:(1)提出假设:物质发生化学变化后,总质量
不变
不变
(填“变”或“不变”).(2)设计实验方案:按你的假设小明设计了如图装置的实验,实验进行时把气球中的铁粉倒入稀硫酸中,此反应的化学方程式为:
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.(2011?香坊区二模)某校化学活动小组的同学欲用氧化铜、铁粉和稀硫酸为原料制备金属铜.
[设计与实验]实验过程和相应的现象如图所示: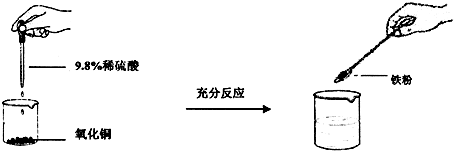
[交流与讨论]
(1)学生甲最终实验得到固体的成分是
(2)学生丙在加入铁粉后,发生反应的化学方程式:
(3)三位同学中制得铜质量最多的是
查看习题详情和答案>>
[设计与实验]实验过程和相应的现象如图所示:

| 学生甲 | 学生乙 | 学生丙 | |
| 氧化铜的质量(g) | 8 | 8 | 8 |
| 9.8%稀硫酸的质量(g) | 50 | 100 | 150 |
| 铁粉的质量(g) | 5.6 | 5.6 | 5.6 |
| 加入铁粉后的现象 | 有红色和黑色固体 | 有红色固体 | 有红色固体 |
(1)学生甲最终实验得到固体的成分是
CuO、Cu、Fe
CuO、Cu、Fe
;(2)学生丙在加入铁粉后,发生反应的化学方程式:
Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=FeSO4+Cu;
;(3)三位同学中制得铜质量最多的是
乙
乙
同学.你的分析理由是8g氧化铜中含铜6.4g.甲实验中的氧化铜过量,加入5.6g铁,只能置换出3.2g铜;乙实验中,氧化铜、硫酸和铁均恰好完全反应,生成6.4g铜;丙实验中的硫酸过量,加入铁粉后,有一部分铁与硫酸反应生成硫酸亚铁,一部分铁与硫酸铜反应置换出铜,所以得到铜的实际质量小于6.4g,所以乙得到的铜最多
8g氧化铜中含铜6.4g.甲实验中的氧化铜过量,加入5.6g铁,只能置换出3.2g铜;乙实验中,氧化铜、硫酸和铁均恰好完全反应,生成6.4g铜;丙实验中的硫酸过量,加入铁粉后,有一部分铁与硫酸反应生成硫酸亚铁,一部分铁与硫酸铜反应置换出铜,所以得到铜的实际质量小于6.4g,所以乙得到的铜最多
.