摘要:1.排除定势思维的干扰.透过现象看本质 对于离子在溶液中的存在状态的判断.很多学生把离子的水解与离子浓度大小的情况混淆.其实离子的水解或弱电解质的电离都是比较弱的.所以对于溶液中本身能够电离产生的离子浓度均是最大的.
网址:http://m.1010jiajiao.com/timu_id_4028294[举报]
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为
(2)实验①的目的是
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是
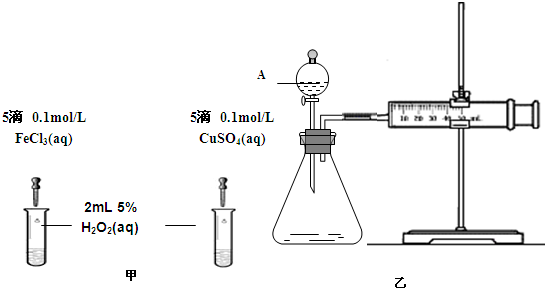
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图2甲、乙所示的实验.请回答相关问题:

①定性分析:如图2甲可通过观察
②定量分析:用图2乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是
查看习题详情和答案>>
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(2)实验①的目的是
研究温度对H2O2分解速率的影响
研究温度对H2O2分解速率的影响
.实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察
加快H2O2分解速率,使实验现象易于观察
.(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是
将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率
将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率
(用实验中所提供的几种试剂).(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图1所示,则A、B、C三点所表示的瞬时反应速率最慢的是
C点的即时速率
C点的即时速率
.(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图2甲、乙所示的实验.请回答相关问题:

①定性分析:如图2甲可通过观察
溶液中气泡产生的速率
溶液中气泡产生的速率
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰(合理即可)
排除氯离子的干扰(合理即可)
.②定量分析:用图2乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是
收集40mL气体所需的时间
收集40mL气体所需的时间
.为了测定不同电解质的水溶液的导电能力是否相同,设计如下图所示的实验
请回答下列问题:
(1)本实验取了盐酸,CH3COOH溶液,NaOH溶液,NaCL溶液和氨水五种溶液,若要再增加一种溶液,你认为选取下列哪种溶液最为合适?
A.硫酸钠B.氯化钙C.氢氧化钡D.硝酸钾
(2)为了排除无关因素的干扰,本实验应控制多种实验条件,如烧杯的规格相同,烧杯内溶液的体积相等、相同的电极材料、各电极间的距离相等、溶液的温度相同等,除此外,你认为还应控制的最关键的条件(或因素)是

(3)本实验通过观察到
(4)通过本实验,证实了不同的电解质溶液导电能力是不同的,从而可直接推出的结论是
查看习题详情和答案>>
请回答下列问题:
(1)本实验取了盐酸,CH3COOH溶液,NaOH溶液,NaCL溶液和氨水五种溶液,若要再增加一种溶液,你认为选取下列哪种溶液最为合适?
D
D
A.硫酸钠B.氯化钙C.氢氧化钡D.硝酸钾
(2)为了排除无关因素的干扰,本实验应控制多种实验条件,如烧杯的规格相同,烧杯内溶液的体积相等、相同的电极材料、各电极间的距离相等、溶液的温度相同等,除此外,你认为还应控制的最关键的条件(或因素)是
五种溶液的物质的量浓度相同
五种溶液的物质的量浓度相同
.
(3)本实验通过观察到
灯光亮度不同
灯光亮度不同
现象,间接说明不同电解质溶液导电能力是不同的.(4)通过本实验,证实了不同的电解质溶液导电能力是不同的,从而可直接推出的结论是
不同电解质在水中的电离程度是不同的
不同电解质在水中的电离程度是不同的
.(1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度.请完成相关的实验步骤和现象.
可选试剂:①0.1mol?L-1KI溶液;②0.1mol?L-1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4.
实验步骤:
①取5mL 0.1mol?L-1 KI溶液,再滴加5~6滴0.1mol?L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是
查看习题详情和答案>>
可选试剂:①0.1mol?L-1KI溶液;②0.1mol?L-1 FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4.
实验步骤:
①取5mL 0.1mol?L-1 KI溶液,再滴加5~6滴0.1mol?L-1FeCl3溶液
②充分反应后,将溶液分成三份
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘.
④另取一份,滴加试剂
KSCN溶液
KSCN溶液
,现象溶液显血红色
溶液显血红色
,说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度)
Fe3+没有反应完(或KI和FeCl3的反应有一定的限度)
.(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察
溶液中气泡产生的速率
溶液中气泡产生的速率
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是排除氯离子的干扰
排除氯离子的干扰
.②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.实验中需要测量的数据是
收集40mL气体所需的时间
收集40mL气体所需的时间
.
(2011?中山三模)实验室用浓盐酸和二氧化锰制备氯气并用所制氯气制备少量氯水的装置图如下,回答有关问题.
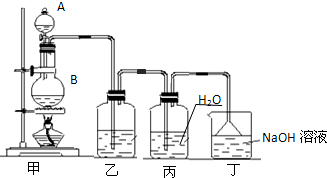
(1)从仪器A向仪器B中加入浓盐酸的操作方法是
(2)装置乙中盛放的试剂是
(3)写出氯气与水反应的化学方程式
(4)某同学设计了一个实验方案以证明新制氯水中含有次氯酸.他所用的试剂如下:
新制氯水 0.5mol.L-1CaCl2溶液 品红溶液 CaCO3粉末
请你协助完成实验方案.
步骤一:取5mL0.5mol.L-1CaCl2溶液于试管中,滴入3滴品红溶液,振荡,溶液不褪色.
步骤二:取5mL新制氯水于试管中,
步骤三:
说明新制氯水中存在次氯酸的实验现象是
(5)设计步骤一的理由是
查看习题详情和答案>>

(1)从仪器A向仪器B中加入浓盐酸的操作方法是
取下分液漏斗上口玻璃塞,旋动活塞,即可放下液体
取下分液漏斗上口玻璃塞,旋动活塞,即可放下液体
.反应中控制氯气产生速率大小的方法是通过控制浓盐酸的加入速度来控制氯气的产生速率
通过控制浓盐酸的加入速度来控制氯气的产生速率
.(2)装置乙中盛放的试剂是
饱和食盐水
饱和食盐水
,其作用是除去氯气中的氯化氢
除去氯气中的氯化氢
.(3)写出氯气与水反应的化学方程式
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.(4)某同学设计了一个实验方案以证明新制氯水中含有次氯酸.他所用的试剂如下:
新制氯水 0.5mol.L-1CaCl2溶液 品红溶液 CaCO3粉末
请你协助完成实验方案.
步骤一:取5mL0.5mol.L-1CaCl2溶液于试管中,滴入3滴品红溶液,振荡,溶液不褪色.
步骤二:取5mL新制氯水于试管中,
加入碳酸钙粉末充分反应至溶液无色
加入碳酸钙粉末充分反应至溶液无色
.步骤三:
取上层清液于另一试管中加入3滴品红溶液,振荡
取上层清液于另一试管中加入3滴品红溶液,振荡
.说明新制氯水中存在次氯酸的实验现象是
品红溶液褪色
品红溶液褪色
.(5)设计步骤一的理由是
氯水与碳酸钙反应后生成氯化钙溶液,为证明品红溶液褪色是次氯酸的作用,须实验证明氯化钙溶液不具漂白性(或“排除氯化钙溶液的干扰”)
氯水与碳酸钙反应后生成氯化钙溶液,为证明品红溶液褪色是次氯酸的作用,须实验证明氯化钙溶液不具漂白性(或“排除氯化钙溶液的干扰”)
.