摘要:1.考点阐释: 考点1:电解质 ⑴概念: 电解质:在水溶液中或熔融状态下能够导电的化合物.如:酸.碱.盐和水等. 非电解质:在水溶液中和熔融状态下都不导电的化合物. ⑵强电解质和弱电解质 强电解质 弱电解质 定义 溶于水可完全电离的电解质 溶于水只有部分电离的电解质 化合物类型 离子化合物记忆部分共价化合物 一部分 电离程度 完全电离 部分电离.存在电离平衡 溶液中存在的粒子 阴阳离子和水分子 阴阳离子.电解质分子以及水分子 物质种类 强酸.强碱.大多数盐 弱酸.弱碱和水 电离方程式 H2SO4 = 2 H+ + SO42- Ca(OH)2 = Ca2+ + 2 OH- NaHCO3 = Na+ + HCO3- CH3COOHCH3COO-+ H+ NH3·H2ONH4+ + OH- H2O H+ + OH- ⑶弱电解质的电离平衡 概念:在一定条件下.当电解质分子电离成离子的速率与离子重新结合生成分子的速率相等时.电离过程就达到了平衡状态.叫电离平衡. 影响电离平衡的因素 ①温度:升高温度.平衡向电离方向移动.但如果溶质为挥发性物质.则加热会导致浓度下降. ②浓度:将弱电解质加水稀释.平衡向电离方向移动,减少生成物浓度.可以促进电离,加入与阴阳离子相同的离子时.则产生同离子效应.抑制电解质的电离. ⑷电离方程式的书写 ①强电解质的电离应用“= 连接.弱电解质的电离用“ 连接. ②多元弱酸的电离为分步电离.且第一步为主要过程.起决定作用.而多元弱碱的电离则可一步书写. 考点2.水的电离和溶液的pH 水的电离:H2O H+ + OH-.属于吸热反应.25℃时.水的离子积常数为1×10-14, ⑴影响水的电离程度的因素 ①温度:升高温度.水的电离程度增强.水的离子积增大. ②酸或碱:加入酸和碱时都会抑制水的电离.但在稀溶液中.水的离子积常数不变. ③易水解的盐:盐类的水解可促进水的电离. ⑵溶液的酸碱性和pH值 溶液酸碱性的判断:当c (H+) = c (OH-) 时.溶液呈中性, 当c (H+) > c (OH-) 时.溶液呈酸性, 当c (H+) < c (OH-) 时.溶液呈碱性. 若溶液中的c (H+) 在1×10-14mol/L~1mol/L之间时,常用pH来表示,pH = -[ lg c(H+)] 因此在25℃时.当pH = 7.溶液为中性,pH < 7.溶液为酸性,pH > 7时.溶液为碱性. ⑶溶液中pH的计算: ①酸的pH:先求溶液中c (H+).再根据公式计算pH.当溶液为强酸时.加水稀释时.每稀释10倍.pH增加1.但溶液的pH只能接近7.如果为弱酸.则增加的幅度比强酸小.②②碱的pH值:先求溶液中的 c (OH-).由水的离子积常数求出c (H+).进而求出pH.如果为强碱.每稀释10倍.pH降低1.但溶液的pH只能接近7,若为弱碱.则降低的幅度小于强碱. ②酸与酸混合:当两种强酸混合时.先由H+ 的物质的量与溶液的体积求出c (H+).然后求出pH值 ③碱与碱混合:当两种强碱混合时.先求出由OH-的物质的量和溶液的体积求出 c (OH-).由水的离子积常数求出c (H+).进而求出pH. ④酸碱混合时:首先判断哪种物质过量.来判断溶液的酸碱性.如果为酸性.则通过求得c (H+)而得到pH值,若为碱性.则首先计算 c (OH-).由水的离子积解得c (H+).进而求出pH. 考点3:盐类水解 ⑴盐类水解的实质:盐中电离产生的阴离子或阳离子与水中电离产生的H+或OH-结合为更弱的电解质.从而减少了溶液中的H+或OH-.促进了水的电离. ⑵盐类水解的结果:促进水的电离.影响了溶液的酸碱性. 酸性:强酸弱碱盐 碱性:强碱弱酸盐 中性:强酸强碱盐 弱酸弱碱盐的酸碱性由阴阳离子的水解程度决定. ⑶影响盐类水解的因素 因素 水解平衡的影响 c (H+)或 c (OH-) 内因 水解的阴阳离子对应的酸或碱越弱.水解程度越强 外因 温度 升温 水解程度增大 增大 降温 水解程度减小 减小 浓度 加水 水解程度增大 减小 加盐 水解程度减小 增大 溶液的酸碱性 加酸 抑制阳离子的水解 c (H+)增大.c (OH-)减小 加碱 抑制阴离子的水解 c (H+)减小.c (OH-)增大 ⑷判断酸碱反应后溶液的pH ①强酸强碱反应时.酸碱恰好完全反应与溶液为中性属于同一状态, ②强酸弱碱反应时.弱恰好完全反应.则溶液呈酸性.溶液呈中性时.为碱过量, ③强碱与弱酸反应.恰好完全反应时.溶液显碱性.溶液为中性时.酸过量. 考点4.酸碱中和滴定 ⑴实验原理以及目的:H+ + OH-= H2O .根据在反应过程中溶液的pH的变化情况.可以由已知浓度的酸(碱)测定未知浓度的酸(碱)的浓度. ⑿实验所用试剂和仪器:酸式滴定管.碱式滴定管.锥形瓶.铁架台等.标准溶液.待测溶液以及酸碱指示剂 ⑵中和滴定过程中的注意事项: ①滴定管的使用:先检验是否漏水.然后用水清洗.再用待装溶液洗涤2~3次..排除尖嘴处的气泡,装溶液.并调节溶液的高度在刻度线之内.记录体积.保留小数点后两位. ②滴定时用移液管或滴定管取待测液于锥形瓶中.并加入指示剂.滴定时眼睛注视锥形瓶中颜色的变化以及溶液的流速.当滴入溶液后30秒后溶液颜色不再变化.则可以判断反应进行完毕.记录所有标准液的体积.根据公式c (H+) v (酸) = c (OH-) v (碱).计算出待测溶液的浓度.
网址:http://m.1010jiajiao.com/timu_id_4028274[举报]
 (2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.
(2012?江苏三模)卤素性质活泼,能形成卤化物、多卤化物等多种类型的化合物.(1)卤化氢中,HF的沸点高于HCl,原因是
HF分子间形成氢键
HF分子间形成氢键
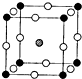
.(2)如图所示为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“O”表示的离子是
F-
F-
(填离子符号).(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为
RbCl
RbCl
.(4)BF3与NH3,能发生反应生成X(H3BNF3),X的结构式为


sp3
sp3
.(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等].(CN)2的结构式为N≡C-C≡N,该分子中σ键和π键数目之比为
3:4
3:4
.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子.
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: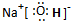
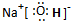 .
.
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为
查看习题详情和答案>>
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是
D
D
(填序号).(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:
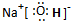
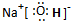
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
HClO和NH3(NH3?H2O)
HClO和NH3(NH3?H2O)
.(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
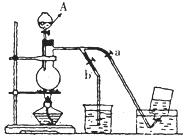 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)(1)仪器A的名称是
分液漏斗
分液漏斗
;水槽中应盛放的是饱和食盐水
饱和食盐水
;烧杯中盛放的是氢氧化钠溶液
氢氧化钠溶液
;烧瓶中反应的化学方程式MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(2)在收集氯气时,应
关闭b,打开a
关闭b,打开a
.当氯气收集完毕时应关闭a,打开b
关闭a,打开b
.(填如何控制a、b)(2012?江苏三模)合理地固定和利用CO2能有效减少空气中的温室气体,产物还能造福人类.
(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H2S和CO2合成(C6H10O5)n和一种淡黄色固体,该反应的化学方程式为
(2)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的△H=
②一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min-1,生产0.3mol二甲醚需通入CO2的物质的量为
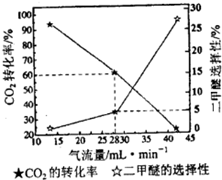
③反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH3OH,t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,此时v正
④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为
(3)一种“碳捕捉”技术为:将含CO2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO2可用于制备甲醇等.该技术电可以循环使用的物质为
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30小时内,CH4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为
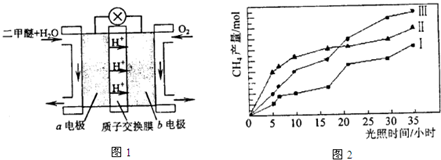
查看习题详情和答案>>
(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H2S和CO2合成(C6H10O5)n和一种淡黄色固体,该反应的化学方程式为
12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O
12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O
.(2)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的△H=
-121.5kJ/mol
-121.5kJ/mol
.②一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min-1,生产0.3mol二甲醚需通入CO2的物质的量为
20mol
20mol
.
③反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH3OH,t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,此时v正
=
=
v逆(填“>”、“<”或“等于”)④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.(3)一种“碳捕捉”技术为:将含CO2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO2可用于制备甲醇等.该技术电可以循环使用的物质为
氧化钙和氢氧化钠
氧化钙和氢氧化钠
.(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30小时内,CH4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
.