网址:http://m.1010jiajiao.com/timu_id_4025250[举报]
在一定温度下将各1molCO和水蒸气放在密闭的容器中反应:CO(g)+H2O(g) CO2(g)+ H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
A.等于0.6mo B.等于1mol
C.大于0.6mol小于1mol D.大于1mol
查看习题详情和答案>>
(14分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡, v(H2)=
;该温度下CO(g)+2H2(g)
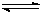 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看习题详情和答案>>
能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。

请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是
A.起始充入的CO为1mol ks5u
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态ks5u
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大ks5u
(3)从反应开始到建立平衡, v(H2)= ;该温度下CO(g)+2H2(g) ![]() CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2)。
(5)科学家常用 (填仪器名称)来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol,又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看习题详情和答案>>
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为______.
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH
 2Ni(OH)2
2Ni(OH)2根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH______(填“增大”、“减小”或“不变”),该电极的电极反应式为______.
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=______(结果保留两位有效数字).
若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”). 20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是______(填字母).
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④

 查看习题详情和答案>>
查看习题详情和答案>>

(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1mol水蒸气放热569.1kJ.则该反应的热化学方程式为
(2)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH
| 放电 | 充电 |
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH
(3)汽车尾气的主要成分是一氧化碳和氮氧化物,治理尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.

若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.则从开始到达到平衡状态的过程中,平均反应速率v(CO2)=
若保持温度不变,20min时向容器中充入CO、N2各0.6mol,平衡将
①加入催化剂 ②降低温度
③缩小容器体积 ④增加CO2的物质的量
A.只有①B.只有②C.只有③D.只有④