摘要:例1.已知在800K时.反应:CO(g)+H2O(g) CO2(g)+H2=2mol/L.c(H2O)=3mol/L.反应达到平衡时.CO转化成CO2的转化率为60%.若将H2O的起始浓度加大为6mol/L.试求CO转化为CO2的转化率. 解析:本题考查平衡常数表达式.有关计算及应用. 先由第一次平衡时CO的转化率可求平衡时各物质的浓度:c(CO)=0.8mol/L.c(H2O) 例2. 现有反应:CO(气) + H2O(气)CO2(气) + H2(气)放热反应,在850℃时.K=1. (1)若升高温度到950℃时.达到平衡时K l (填“大于 .“小于 .或“等于 ) (2)850℃时.若向一容积可变的密闭容器中同时充入1.0molCO.3.0molH2O.1.0molCO2和xmolH2.则:当x=5.0时.上述反应向 (填“正反应 或“逆反应 )方向进行.若要使上述反应开始时向正反应方向进行.则x应满足的条件是 . 解析:化学平衡常数不随浓度或压强的改变而改变.只随温度的改变而改变. (1)对于CO(气) + H2O(气)CO2(气) + H2(气).正反应为放热反应.升高温度平衡逆向移动.生成物的浓度减小.反应物的浓度增大.根据平衡常数的计算公式可知.K变小.即小于1. (2) 在一容积可变的密闭容器中同时充入1.0molCO.3.0molH2O.1.0molCO2和xmolH2.当x=5.0时.则有:K=5×1/3×1>1.此时生成的浓度偏大.而在同一温度下平衡常数保持不变.则必然随着反应的进行.生成物的浓度降低.平衡逆向移动. 若要使平衡正向移动.则有:K=x×1/3×1<1.即x<3时.可使平衡正向移动. 测得吸入肺部的空气中CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1.并已知37℃时上述反应的平衡常数K=220.那么.此时Hb•CO的浓度是Hb·O2的浓度的多少倍? 解析:根据平衡常数的概念和计算公式: 生成物浓度的幂次方乘积与反应物浓度的幂次方乘积之比是常数.可得: 又因为:肺部的空气CO和O2的浓度分别为10-6mol·L-1和10-2mol·L-1.则: 则有:=2.2% 答案:Hb•CO的浓度是Hb·O2的浓度的0.022倍 例4. 在合成氨过程中.进入合成塔的氮气和氢气的体积比为1:3.压强为160atm.从合成塔出来的混合气体中氨的体积分数为25%.求: (1)从合成塔出来的气体中氮气和氢气的体积比是多少? (2)从合成塔出来的气体的压强是多少? 解析:同温同压下.任何气体的体积比等于物质的量之比.则根据平衡常数的计算公式: 从合成塔出来的气体的压强是128atm. 例5. 在一定温度下.将100mL氢气和氮气的混合气体充入密闭容器中进行反应.达到平衡时维持温度不变.测得混合气体的密度是反应前的1.25倍.平均分子量为15.5.则达到平衡时氮气的转化率为多少? 解析:在同温同压下.反应前后的气体的总质量保持不变.则混合气体的密度与体积成反比.设混合气体中氮气的体积为a.则氢气的体积为:100-a.则有: N2 + 3H2 2NH3 起始(L) a 100-a 0 转化(L) x 3x 2x 平衡(L) a-x 100-a-3x 2x 则有:ρ前/ρ后=V前/V后,100/=1.25.x=10mL. 又同温同压下.气体的体积比等于物质的量之比.则有: 混合气体的相对分子质量等于混合气体的总质量与混合气体的总物质的量之比.则有:混合气体的总质量=28a+2. 则有:[28a+2]/100-2x=15.5.可得: a=40 mL 则:氮气的转化率为:10/40=25% 答案:氮气的转化率为25% [专题测试]1.在某温度下.可逆反应mA(g)+nB(g)pC(g)+qD(g)的平衡常数为K.下列说法正确的是 A. K越大.达到平衡时.反应进行的程度越大 B. K越小.达到平衡时.反应物的转化率增大 C. K随反应物浓度的改变而改变 D. K随温度的改变而改变
网址:http://m.1010jiajiao.com/timu_id_4025245[举报]
 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ?mol-1
③H2O(l)=H2O(g)△H=+44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=_447.8 kJ?mol-1
CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=_447.8 kJ?mol-1
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.则电源中a极为
正
正
极(填“正”或“负”),其电极反应式为O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.装置上端A极电极材料是Fe
Fe
(填化学式),B电极上的电极反应式为2H++2 e-=H2↑
2H++2 e-=H2↑
.(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
放
放
(填“吸”或“放”)热反应.②实验1中,以v(H2)表示的平均反应速率为
0.16mol/(L?min)
0.16mol/(L?min)
.③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6mol和0.8mol分别加入该容器,则此时反应的v(正)
<
<
v(逆)(填“>”“<”或“=”中之一).④实验3跟实验2相比,改变的条件可能是
使用了催化剂;加大了压强
使用了催化剂;加大了压强
.运用盖斯定律可计算一些不易测定的反应的反应热.
(1)已知在298K时下述反应的有关数据:C(s)+
O2(g)=CO(g)△H1=-110.5kJ?mol-1,C(s)+O2(g)=CO2(g)△H2=-393.5kJ?mol-1.则C(s)+CO2(g)=2CO(g) 的△H为
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-l.则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
查看习题详情和答案>>
(1)已知在298K时下述反应的有关数据:C(s)+
| 1 | 2 |
+172.5kJ?mol-1
+172.5kJ?mol-1
.(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气.已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-l;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-l.则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1
.甲醇是一种燃料,也可以作为燃料电池的原料.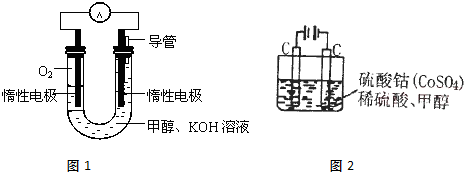
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6KJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0KJ/mol
③H2O(g)=H2O(l)△H3=-44.0KJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置,则电池正极的电极反应式:
(3)甲醇对水质会造成一定的污染,用如图2所示的电化学法可消除这种污染,原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.则用该装置净化含10mol甲醇的水,转移电子数为
查看习题详情和答案>>

(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6KJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0KJ/mol
③H2O(g)=H2O(l)△H3=-44.0KJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol
;(2)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置,则电池正极的电极反应式:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,该电池工作时,溶液中的OH-向负
负
极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O
2CH3OH+3O2+4OH-=2CO32-+6H2O
;(3)甲醇对水质会造成一定的污染,用如图2所示的电化学法可消除这种污染,原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.则用该装置净化含10mol甲醇的水,转移电子数为
60NA
60NA
.氨在国民经济中占有重要的地位,请参与下列探究
(1)已知在400℃时,2NH3(g)?N2 (g)+3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+3H2(g)?2NH3(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正
(2)已知:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1…①
O2(g)+
N2(g)=NO2(g)△H=+33.9kJ?mol-1…②
H2(g)+
N2(g)=NH3(g)△H=-46.0kJ?mol-1…③
H2O(l)=H2O(g)△H=+44kJ?mol-1…④
则表示NH3燃烧热的热化学方程式为
查看习题详情和答案>>
(1)已知在400℃时,2NH3(g)?N2 (g)+3H2(g) (△H>0)的平衡常数K=2,
①400℃时,N2 (g)+3H2(g)?2NH3(g)的K=
0.5
0.5
(填数值).②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(NH3)正
=
=
V(NH3)逆(填:>、<、=、不能确定).(2)已知:H2(g)+
| 1 |
| 2 |
O2(g)+
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
H2O(l)=H2O(g)△H=+44kJ?mol-1…④
则表示NH3燃烧热的热化学方程式为
NH3(g)+
O2(g)=
N2(g)+
H2O(l);△H=-382.7kJ/mol
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |
NH3(g)+
O2(g)=
N2(g)+
H2O(l);△H=-382.7kJ/mol
.| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 2 |