摘要:物质的检验 (1)鉴定.鉴别与推断的比较 不同点 相同点 鉴定 根据物质的化学性质.对一种物质分别检验出阴.阳离子 均需根据物质的特征反应.选择恰当的试剂和方法.准确观察反应中颜色变化.沉淀的生成或溶解.气体的生成.焰色等现象加以判定 鉴别 对两种或两种以上的物质进行辨认 推断 通过已知实验事实.根据性质分析.推出被检物质的组成或名称 (2)常见物质的检验方法 根据物质性质(主要是化学性质.物理性质往往也是重要线索).使被检验物质与加入的试剂作用.转变为某种已知物质.或产生某种特殊现象.从而确定该物质的存在.常见的特殊现象有: ①生成气体:能够生成气体的离子很多.生成的气体也常有性质的相似之处.判断时要注意干扰. ②生成沉淀:许多金属阳离子或酸根阴离子都可生成具有特殊颜色.特殊性质的沉淀.但同时也应注意排除干扰离子. ③显现特殊颜色:特殊颜色的出现或消失并配合特殊试剂.是鉴别物质的常见方法.如KSCN检验Fe3+.苯酚检验Fe3+.酸性KMnO4检验不饱和化合物.新制Cu(OH)2悬浊液检验醛类物质等.
网址:http://m.1010jiajiao.com/timu_id_4025111[举报]
现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4.进行如下实验:①溶于水得无色澄清溶液;②取少量所得溶液,加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失.根据上述实验现象推断:
(1)一定不存在的物质是
(2)写出发生反应的离子方程式
(3)对于可能存在的物质的检验方法是(写出操作步骤、现象和结论).
查看习题详情和答案>>
(1)一定不存在的物质是
CaCO3、Na2SO4、CuSO4
CaCO3、Na2SO4、CuSO4
,一定存在的物质是Na2CO3
Na2CO3
;(2)写出发生反应的离子方程式
Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
,2H++BaCO3=CO2↑+H2O+Ba2+
2H++BaCO3=CO2↑+H2O+Ba2+
;(3)对于可能存在的物质的检验方法是(写出操作步骤、现象和结论).
取①中溶液,加入过量硝酸,再加硝酸银溶液,若有白色沉淀产生,则固体中含NaCl,若无白色沉淀产生,则固体中不含NaCl.
取①中溶液,加入过量硝酸,再加硝酸银溶液,若有白色沉淀产生,则固体中含NaCl,若无白色沉淀产生,则固体中不含NaCl.
.W、X、Y、Z是元素周期表前36号元素中的四种常见元素,其相关信息如下表:
(1)X单质在常温下与F2反应生成气态化合物XF4,该化合物晶体类型为 ;在加热或高温时X可与C12、Br2、I2反应生成XC14、XBr4、XI4.XC14的空间构型为 ,在X-F、X-Cl、X-Br、X-I四种共价键中,键能最小的是 .(用具体元素符号表示)
(2)Y位于元素周期表 区;Y在O2中燃烧产物与足量稀硝酸反应的离子方程式为 .
(3)Z+基态核外电子排布式为 ,ZCl2加热至773K分解为ZCl 的化学方程式为 .
(4)W的最高价氧化物与焦炭按物质的量1:3混合加热,生成CO2和化合物M,M的化学式为: .
查看习题详情和答案>>
| 元素 | 相关信息 |
| W | 最高价氧化物既能与强碱又能与强酸反应形成盐和水,又可作耐火材料 |
| X | 以化合态广泛存在于自然界,单质可用于制造集成电路 |
| Y | 基态原子核外有4个未成对电子 |
| Z | 其硫酸盐常用于检验或除去乙醇、乙醚等有机溶剂中的少量水分 |
(2)Y位于元素周期表
(3)Z+基态核外电子排布式为
(4)W的最高价氧化物与焦炭按物质的量1:3混合加热,生成CO2和化合物M,M的化学式为:
下列叙述中,错误的是( )
| A、苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | B、乙烷与氯气在铁作用下生成一氯乙烷 | C、乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | D、向含有苯酚的溶液中加入三氯化铁溶液,溶液呈现紫色,常用于酚类物质的检验 |
现有一包固体粉未,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4.现进行如下实验:
①溶于水得无色溶液;
②向溶液中加入氯化钡溶液生成白色沉淀,再加盐酸时沉淀消失.
根据上述实验现象推断:
(1)一定不存在的物质是:
(2)一定存在的物质是:
(3)可能存在的物质是:
(4)对于可能存在的物质的检验方法是(写出简要的步骤和有关的离子方程式):
查看习题详情和答案>>
①溶于水得无色溶液;
②向溶液中加入氯化钡溶液生成白色沉淀,再加盐酸时沉淀消失.
根据上述实验现象推断:
(1)一定不存在的物质是:
CaCO3、Na2SO4、CuSO4
CaCO3、Na2SO4、CuSO4
.(2)一定存在的物质是:
Na2CO3
Na2CO3
.(3)可能存在的物质是:
NaCl
NaCl
.(4)对于可能存在的物质的检验方法是(写出简要的步骤和有关的离子方程式):
取固体粉未少许,加水溶解后,加入稀硝酸酸化,再加硝酸银溶液,如果有白色沉淀生成,则说明含有NaCl,CO32-+2H+═CO2↑+H2O、Ag++Cl-═AgCl↓
取固体粉未少许,加水溶解后,加入稀硝酸酸化,再加硝酸银溶液,如果有白色沉淀生成,则说明含有NaCl,CO32-+2H+═CO2↑+H2O、Ag++Cl-═AgCl↓
.
如图是中学化学实验中常见的制备气体并进行某些物质的检验和性质实验的装置,A是制备气体的装置,C、D、E、F中盛装的液体可能相同,也可能不同.试回答:
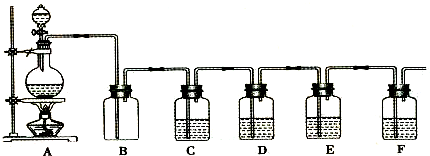
(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式: ,若要检验生成的产物,则B、C、D、E、F中应分别加入的试剂为 、 、 、 、 ,E中试剂和C中相同,E中试剂所起的作用 ,B装置除可检出某产物外,还可起到 作用.
(2)若进行上述实验时在F中得到10.0g固体,则A中发生反应转移的电子数为 个.
(3)若A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶.如果要比较Cl2、Br2的氧化性,验证潮湿Cl2的漂白性,则C、D、E、F中的试剂分别是 、 、 、 ,F中的试剂所起的作用是 .
查看习题详情和答案>>

(1)如果A中的固体物质是碳,分液漏斗中盛装的是浓硫酸,试写出发生的化学反应方程式:
(2)若进行上述实验时在F中得到10.0g固体,则A中发生反应转移的电子数为
(3)若A中是NaClO3和NaCl的混合物,分液漏斗中装有浓硫酸,B是空瓶.如果要比较Cl2、Br2的氧化性,验证潮湿Cl2的漂白性,则C、D、E、F中的试剂分别是