摘要:3.SO2的来源和酸雨(PH> )形成.危害 及其防治方法 [例3]关于酸雨的下列分析正确的是 A.因空气中无催化剂.SO2不能转化成SO3.酸雨中只含H2SO3 B.SO2在空气中有条件形成SO3.所以酸雨中含H2SO4 C.酸雨是无法避免的 D.硫在足量空气中燃烧成SO3.然后被水吸收形成酸雨 [例4]为防治酸雨.降低煤燃烧时向大气排放的SO2.工业上将生石灰和含硫煤混合使用.请写出燃烧时.有关“固硫 (不使含硫化合物进入大气)反应的化学方程式: .
网址:http://m.1010jiajiao.com/timu_id_4021462[举报]
空气中______的氧化物和______的氧化物,随雨水降下就成为酸雨.酸雨的pH小于______.
空气中SO2的来源主要是______的燃烧,以及______的冶炼和硫酸、磷肥、纸浆生产等产生的工业废气.
查看习题详情和答案>>
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.(1)下列有关酸雨的说法正确的是
D
D
(填序号).A.SO2、NO2或CO2都会导致酸雨的形成
B.NO不溶于水,所以不会造成酸雨污染
C.燃煤时鼓入足量空气,可以减少酸雨的产生
D.采用清洁能源,可以减少酸雨的产生
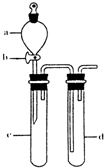
(2)某兴趣小组采用如图装置制取并探究SO2气体的性质.
①下列实验方案适用于用右图所示装置制取所需SO2的是
B
B
(填序号).A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好
试管d中加水至浸没长导管口,(塞紧试管c和d的胶塞,)加热c(或用手捂热c),试管d中有气泡冒出,停止加热后,试管d中有一段水柱上升,说明装置气密性良好
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
AD
AD
(填序号).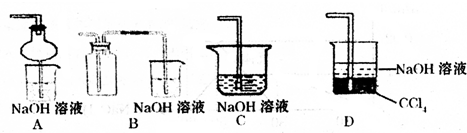
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性.为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是
A
A
原因是SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成
SO2和Fe2+都可以使KMnO4溶液褪色,所以无法确定一定有Fe2+生成
.煤是一种常用的燃料,由于煤燃烧产生的废气含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放
(1)将煤直接进行燃烧,造成环境污染的主要方面之一是形成硝酸型酸雨①写出有关物质转化为硝酸的化学方程式
②以下是对硝酸型酸雨的若干项评价,其中正确的是
a:杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
b:对电线,铁轨,桥梁,房屋等均会造成严重损害
c:导致臭氧层空洞
d:硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥.
e:使林木生长缓慢或死亡,农作物减产
(2)对煤用石灰石进行脱硫处理,过程中发生的方程式为:
(3)脱硫后,在废气中含有的不良气体是
(4)检验脱硫后废气中是否含有SO2的简单方法是
查看习题详情和答案>>
(1)将煤直接进行燃烧,造成环境污染的主要方面之一是形成硝酸型酸雨①写出有关物质转化为硝酸的化学方程式
2NO+O2═2NO2
2NO+O2═2NO2
、3NO2+H2O═2HNO3+NO
3NO2+H2O═2HNO3+NO
.②以下是对硝酸型酸雨的若干项评价,其中正确的是
abd
abd
a:杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
b:对电线,铁轨,桥梁,房屋等均会造成严重损害
c:导致臭氧层空洞
d:硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥.
e:使林木生长缓慢或死亡,农作物减产
(2)对煤用石灰石进行脱硫处理,过程中发生的方程式为:
CaCO3═CaO+CO2
CaCO3═CaO+CO2
、CaO+SO2═CaSO3
CaO+SO2═CaSO3
、2CaSO3+O2═2CaSO4
2CaSO3+O2═2CaSO4
.(3)脱硫后,在废气中含有的不良气体是
CO2
CO2
,它对环境的负面影响是使温室效应加剧
使温室效应加剧
.(4)检验脱硫后废气中是否含有SO2的简单方法是
通过品红溶液若不褪色则无SO2,若褪色则有SO2
通过品红溶液若不褪色则无SO2,若褪色则有SO2
.
下表是部分城市某日空气质量日报:
(1)由上表可知,空气质量日报中涉及的污染物主要是 和可吸入颗粒物(PM10);四座城市中,最容易出现酸雨的城市是 .
(2)汽车尾气则是城市大气中氮氧化物的主要来源之一.治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,这些无毒气体是 .
(3)SO2的排放是造成酸雨的主要因素.
①若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的化学反应方程式 .
②若将含二氧化硫废气通入氨水中,能发生多个反应,减少SO2的排放量.请写出其中可能发生的一个氧化还原反应的化学方程式 .
查看习题详情和答案>>
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 40 | 113 | PM10 | Ⅲ |
| D | 42 | 76 | 59 | NO2 | Ⅰ |
(2)汽车尾气则是城市大气中氮氧化物的主要来源之一.治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,这些无毒气体是
(3)SO2的排放是造成酸雨的主要因素.
①若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的化学反应方程式
②若将含二氧化硫废气通入氨水中,能发生多个反应,减少SO2的排放量.请写出其中可能发生的一个氧化还原反应的化学方程式
煤是一种常用的燃料,由于煤燃烧产生的废气含有SO2、NO2和NO等多种有害气体和烟尘会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放
(1)将煤直接进行燃烧,造成环境污染的主要方面之一是形成硝酸型酸雨
①写出有关物质转化为硝酸的化学方程式
②以下是对硝酸型酸雨的若干项评价,其中正确的是
a:杀死水中的浮游生物,减少鱼类食物的来源,破坏水生生态系统
b:对电线,铁轨,桥梁,房屋等均会造成严重损害
c:导致臭氧层空洞
d:硝酸与土壤中的矿物质发生作用转化为硝酸盐,向植物提供氮肥。
(2)对煤用石灰石进行脱硫处理,过程中发生的方程式为:
(3)脱硫后,在废气中含有的不良气体是 ,它对环境的负面影响是 。
(4)检验脱硫后废气中是否含有SO2的简单方法是 。
查看习题详情和答案>>