摘要:以推断的形式综合考查: 例5:已知A.B.C.D.E都是周期表中前四周期的元素.它们的核电荷数A<B<C<D<E.其中A.B.C是同一周期的非金属元素.化合物DC的晶体为离子晶体.D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B.C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24.ECl3能与B.C的氢化物形成六配位的配合物.且两种配体的物质的量之比为2∶1.三个氯离子位于外界.请根据以上情况.回答下列问题:(答题时.A.B.C.D.E用所对应的元素符号表示) (1)A.B.C的第一电离能由小到大的顺序为 . (2)B的氢化物的分子空间构型是 .其中心原子采取 杂化. (3)写出化合物AC2的电子式 ,一种由B.C组成的化合物与AC2互为等电子体.其化学式为 . (4)E的核外电子排布式是 .ECl3形成的配合物的化学式为 . (5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时.B被还原到最低价.该反应的化学方程式是 . [解析]本题主要考查元素推导.涉及电离能.空间构型.杂化方式.电子式.等电子体.核外电子排布式以及氧化还原反应书写等知识点.A.B.C位于同一周期的三种非金属元素.且B.C在同族中氢化物的沸点最高.可以推断其中含有氢键.由此推测A.B.C位于第二周期的元素.又D的二价阳离子与C阴离子具有相同的结构.则说明D为Mg.由AC2为非极性分子.可推知为CO2.B元素则为N.24号的E则为Cr元素.(1)同一周期第一电离能具有增大的趋势.但由于N具有半充满结构.因而第一电离能最大.即为C<O<N,(2)B的氢化物即为NH3.中心氮原子采取sp3采化.由于有一对孤对电子.所以NH3应为三角锥形,(3)AC2即为二氧化碳.电子式中碳以二对电子分别和两边的氧共用,等子电子体的概念中要明确两点:原子数相等.价电子数相同.(4)24号Cr要注意核外电子的特殊性.即d电子为半充满的稳定结构排布.即[Ar]3d64s1.根据题目中所给信息.CrCl3的配体为NH3和H2O.两者之比为2:1.又总配体为6.则NH3为4个.H2O为2个.又Cl为外界.则配合物不难写出为[Cr(NH3)4(H2O)2]Cl3.(5)B的最高价氧化物对应水化物的化学式为HNO3.还原为最低价时应为-3价.即NH4NO3.D的单质即Mg.应被氧化成Mg2+.然后根据化合价升除总值进行配平即可. [答案]三角锥形 sp3 (3) N2O (4)1s22s22p63s23p63d54s1(或[Ar] 3d54s1) [Cr(NH3)4(H2O)2]Cl3 (5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O [专题训练]
网址:http://m.1010jiajiao.com/timu_id_4021240[举报]
 下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:
下列是治疗口腔炎症的药物华素片(西地碘片)的部分使用说明:| 使用说明书 | |
| 主要成分 | 活性分子碘含量:1.5mg/片 |
| 贮藏 | 遮光、密闭、在阴凉处保存 |
| 有效期 | 二年 |
(1)推断华素片
不是
不是
(填“是”或“不是”)白色.(2)某同学欲证实该药片中确定含有分子碘,设计并完成如下实验:
①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两支试管中备用.
②在甲试管中加入下列一种试剂,振荡、静置,观察到液体分层,上层液体颜色为
紫红(或无)
紫红(或无)
色,所加试剂为下列中的A(或C)
A(或C)
,由此说明分子碘的存在.A.苯 B.酒精 C.四氯化碳 D.盐酸
(3)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
①如以海水为原料制取I2,加入的Cl2要适量,如过量就会发生途径Ⅲ的副反应,在该反应产物中,IO3-与Cl-的物质的量之比为1:6,则氧化剂和还原剂的物质的量之比为
3:1
3:1
.②如以途径Ⅱ在溶液中制取I2,反应后的溶液显酸性,则反应离子方程式是
2IO3-+5HSO3-═5SO42-+H2O+3H++I2
2IO3-+5HSO3-═5SO42-+H2O+3H++I2
. 下列是治疗口腔炎症的药物华素片(西地碘含片)的部分使用说明书:
下列是治疗口腔炎症的药物华素片(西地碘含片)的部分使用说明书:| 使用说明书 | |
| 主要成分 | 活性分子碘含量:1.5mg/片 |
| 贮藏 | 遮光、密闭、在阴凉除保存 |
(1)推断华素片
(2)某同学欲证实该药片中含有碘分子,设计并完成如下实验:
①将药片研碎、溶解、过滤,所得滤液分装于甲、乙两试管中备用.
②向甲试管中加入下列一种试剂,振荡、静置,液体分层,上层液体颜色为
A.苯 B.酒精 C.四氯化碳 D.盐酸
③在乙试管中滴加
(3)碘在地壳中主要以NaI0的形式存在,在海水中主要以I的形式存在,几种粒子之间有如下所示的转化关系:
①如以海水为原料制取I,加入的Cl要适量.如过量就会发生途径Ⅲ的反应,在该反应的产物中,IO
- 3 |
②如用途径Ⅱ在溶液中制取I,反应后的溶液呈酸性,则反应的离子方程式
(2010?聊城一模)【化学--化学与技术】
镁作为目前密度最小的金属材料之一,广泛应用于航空航天工业、军工领域、交通领域.以下为镁的两种冶炼方法.
I.目前宁夏已经探明的镁矿储量居全国第一,青龙山白云岩(CaCO3?MgCO2)是皮江法冶炼镁的优质原料,该方法将白云石煅烧为氧化物(CaO?MgO),然后在还原炉中经1200℃高温真空条件下用硅还原MgO生成粗镁,粗镁再经过精炼、铸锭得到成品镁,工艺流程如图所示.

(1)写出还原炉内用硅还原MgO生成粗镁的化学反应方程式:
(2)在还原过程中反应温度越高镁的产率越高,说明该反应的反应热△H
II.海水综合利用可以制备金属镁,其流程如图所示:
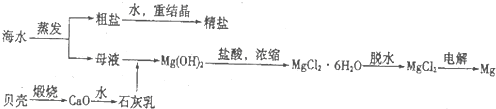
(3)海水中的镁以Mg2+的形式存在,流程中将Mg2+转化为Mg(OH)2,然后又重新转化为Mg2+的目的是
(4)将MgCl2?6H2O在一定条件下加热得到无水MgCl2,“一定条件”指的是
(5)综合比较两种方法,皮江法的缺点是
查看习题详情和答案>>
镁作为目前密度最小的金属材料之一,广泛应用于航空航天工业、军工领域、交通领域.以下为镁的两种冶炼方法.
I.目前宁夏已经探明的镁矿储量居全国第一,青龙山白云岩(CaCO3?MgCO2)是皮江法冶炼镁的优质原料,该方法将白云石煅烧为氧化物(CaO?MgO),然后在还原炉中经1200℃高温真空条件下用硅还原MgO生成粗镁,粗镁再经过精炼、铸锭得到成品镁,工艺流程如图所示.

(1)写出还原炉内用硅还原MgO生成粗镁的化学反应方程式:
2MgO+Si═2Mg+SiO2
2MgO+Si═2Mg+SiO2
.(2)在还原过程中反应温度越高镁的产率越高,说明该反应的反应热△H
大于
大于
0(填“大于”或“小于”)II.海水综合利用可以制备金属镁,其流程如图所示:

(3)海水中的镁以Mg2+的形式存在,流程中将Mg2+转化为Mg(OH)2,然后又重新转化为Mg2+的目的是
提高Mg2+的浓度,起到富集的作用
提高Mg2+的浓度,起到富集的作用
.(4)将MgCl2?6H2O在一定条件下加热得到无水MgCl2,“一定条件”指的是
在HCl气流中
在HCl气流中
.(5)综合比较两种方法,皮江法的缺点是
产生大量温室效应气体、巨大的能量消耗等
产生大量温室效应气体、巨大的能量消耗等
.(2012?岳阳二模)现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)已知BA5为离子化合物,写出其电子式
 .
.
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布如图:该同学所画的电子排布图违背了
(4)G位于
(5)DE3中心原子的杂化方式为
(6)检验F元素的方法是
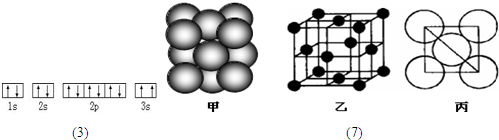
(7)若某单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
查看习题详情和答案>>
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |

(1)已知BA5为离子化合物,写出其电子式


(2)B基态原子中能量最高的电子,其电子云在空间有
3
3
个方向,原子轨道呈纺锤形
纺锤形
形(3)某同学根据上述信息,推断C基态原子的核外电子排布如图:该同学所画的电子排布图违背了
泡利原理
泡利原理
.(4)G位于
第ⅦB
第ⅦB
族d
d
区,价电子排布式为3d54s2
3d54s2
.(5)DE3中心原子的杂化方式为
sp3
sp3
,用价层电子对互斥理论推测其空间构型为三角锥形
三角锥形
.(6)检验F元素的方法是
焰色反应
焰色反应
,请用原子结构的知识解释产生此现象的原因是当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量
.(7)若某单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.则晶胞中该原子的配位数为
12
12
,该单质晶体中原子的堆积方式为四种基本模式中的铜型
铜型
.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图(如图1):
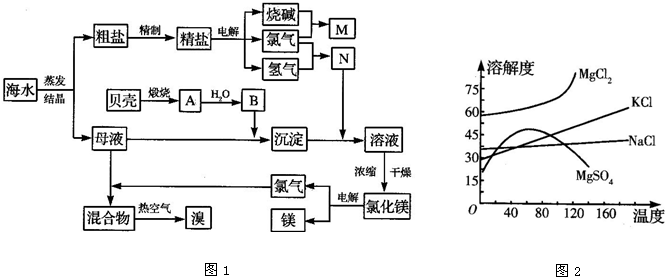
请回答下列问题:
(1)向Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,需要进行的实验操作依次为
A.蒸馏 B.灼烧 C.过滤
D.蒸发 E.冷却结晶
(2)目前工业上主要采用隔膜法电解饱和食盐水,下列关于隔膜电解槽的叙述错误的是
A.隔膜的作用,防止氯气和氢氧化钠、氯气和氢气接触而发生反应
B.电解之前应除去Ca、Mg,以防止电解时生成Ca(OH)2、Mg(OH)2,从而堵塞隔膜
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度曲线如图2所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是
查看习题详情和答案>>

请回答下列问题:
(1)向Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,需要进行的实验操作依次为
DEC
DEC
(填序号).A.蒸馏 B.灼烧 C.过滤
D.蒸发 E.冷却结晶
(2)目前工业上主要采用隔膜法电解饱和食盐水,下列关于隔膜电解槽的叙述错误的是
D
D
(填序号).A.隔膜的作用,防止氯气和氢氧化钠、氯气和氢气接触而发生反应
B.电解之前应除去Ca、Mg,以防止电解时生成Ca(OH)2、Mg(OH)2,从而堵塞隔膜
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度曲线如图2所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是
NaCl和MgSO4
NaCl和MgSO4
;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的KCl
KCl
晶体.