摘要:三氧化二铁和氧化亚铜都是红色粉末.常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3.Cu2O或二者混合物.探究过程如下: 查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中.在所得溶液中再滴加 KSCN 试剂. (1)若假设1成立.则实验现象是 . (2)若滴加 KSCN 试剂后溶液不变红色.则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 ) . (3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 .写出发生反应的离子方程式 . 探究延伸 经实验分析.确定红色粉末为Fe2O3和Cu2O的混合物. (4)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热.待质量不再变化时.称其质量为bg.则混合物中Cu2O的质量分数为 . (5)实验小组欲利用该红色粉末制取较纯净的胆矾 (CuS04 . 5H20) .经查阅资料得知 , 在溶液中通过调节溶液的酸碱性而使Cu2 +.Fe2+.Fe3+分别生成沉淀的pH 如下: 物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀pH 6.0 7.5 1.4 沉淀完全pH 13 14 3.7 实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3 实验小组设计如下实验方案: 试回答: ① 试剂I为 .试剂II为 . ② 固体X的化学式为 . ③ 操作I为 . [解析](1)若假设1成立.则溶液中含有Fe3+.遇到KSCN溶液呈红色. (2)如果混合物中含有Cu2O.遇到酸产生Cu.Cu能与Fe3+反应.故此种说法不正确. (3)若固体全部溶解.则一定存在Fe2O3和Cu2O.因为Cu2O溶于硫酸生成Cu和CuSO4.而H2SO4不能溶解Cu.所以混合物中必须有Fe2O3存在.使其生成的Fe3+溶解产生的Cu. (4)依据题意.能发生反应的物质为Cu2O.最后变成CuO.增加的质量就是反应的氧气的质量.根据质量差计算可以得出Cu2O的质量分数. 3完全沉淀时.pH最小.故应将Fe2+先转化为Fe3+.在利用增大pH的方法除去溶液中的Fe3+.但是所加物质不能增加新的杂质.故第一步氧化剂应是H2O2.再加入Cu2(OH)2CO3.调节pH.使溶液中的Fe3+生成沉淀除去. [答案] (1)溶液变为血红色 (2)不合理 Cu能将Fe3+还原为Fe2+ (3)Fe2O3和Cu2O的混合物 Fe2O3+6H+ = 2Fe3++3H2O Cu2O+2H+ = Cu + Cu2+ + H2O 2 Fe3+ + Cu = 2 Fe2+ + Cu2+ (4) 3 ③加热蒸发 ()
网址:http://m.1010jiajiao.com/timu_id_4020912[举报]
(2010?安徽模拟)已知A、B、C、D、E、F、G、H八种元素位于元素周期表前四个周期.A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物.B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同.请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的o-键和π键的数目之比为
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱
查看习题详情和答案>>
(1)A、B、C形成的此化合物中存在的化学键的类型有
离子键、共价键
离子键、共价键
.E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为3Fe+8H++2NO3-=3Fe2-+2NO↑+4H2O
3Fe+8H++2NO3-=3Fe2-+2NO↑+4H2O
,E的基态离子的电子排布式为[Ar]3d5、[Ar]3d6
[Ar]3d5、[Ar]3d6
,E3+与E2+的稳定性大小为Fe3+>Fe2+
Fe3+>Fe2+
.(2)B、C、D、H四种元素的第一电离能由大到小的顺序为
N>O>P>Al
N>O>P>Al
,电负性由小到大的顺序为Al<P<N<O
Al<P<N<O
.(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的o-键和π键的数目之比为
4:1
4:1
;F、G对应的氢化物中键能大小为F-H键>
>
G-H键.(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为
3:1
3:1
,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为Al3-+3AlO2-+6H2O=4Al(OH)3↓
Al3-+3AlO2-+6H2O=4Al(OH)3↓
.(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱
2H++SO32-=SO2↑+H2O或H++HSO3-=SO2↑+H2O
2H++SO32-=SO2↑+H2O或H++HSO3-=SO2↑+H2O
.由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液呈酸性,则该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为Ba2++2OH-+2HSO3-=BaSO3↓+SO32-+2H2O
Ba2++2OH-+2HSO3-=BaSO3↓+SO32-+2H2O
. (2010?湘潭三模)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).
(2010?湘潭三模)由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去).(1)若A是单质,X气体是09年12月哥本哈根世界气候大会力争实现减排的主要物质,则B与D反应的离子方程式为
HCO3-+OH-=CO32-+H2O
HCO3-+OH-=CO32-+H2O
.(2)若A为淡黄色化合物,D为14电子的双原子气体分子,有毒,则A的电子式为


(3)若D为白色胶状沉淀,且摩尔质量与A相等,则X中一定含
Al
Al
元素(填元素符号)(4)若C可作水是要催熟剂,E是难溶于水的固体,写出A和水反应的化学方程式
MgC2+H2O═C2H2+Mg(OH)2
MgC2+H2O═C2H2+Mg(OH)2
. (2010?南昌一模)下列物质为中学常见物质,它们具有如下转化关系:对它们有如下的推断:
(2010?南昌一模)下列物质为中学常见物质,它们具有如下转化关系:对它们有如下的推断:①X不可能是单质;
②X一定是化合物;
③若n=2,则XYn+1可能是FeCl3;
④若n=l,则XYn可能是NO;
其中正确的是( )
查看习题详情和答案>>
(2010?南昌二模)I.已知P4O6分子结构中每个原子均达到8个电子的稳定结构.1molP4O6中,共价键总数为
II.A、B、C、D均为短周期元素组成的中学教材中常见的物质,且都含有同一种元素,它们具有如下关系:
A+H2O
D↓+x↑
B+H2O
D↓+y↑
C+H2O→D↓+z↑(均未配平)
溶解性:z>y>x.
请回答下列问题:
(1)A、B、C、D中均含有的同种元素在周期表中的位置是:
(2)写出D的电子式: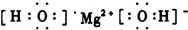
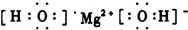 ;y的结构式
;y的结构式
(3)写出A+H2O
D↓+x↑的方程式:
查看习题详情和答案>>
7.224×1024
7.224×1024
.II.A、B、C、D均为短周期元素组成的中学教材中常见的物质,且都含有同一种元素,它们具有如下关系:
A+H2O
| △ |
B+H2O
| △ |
C+H2O→D↓+z↑(均未配平)
溶解性:z>y>x.
请回答下列问题:
(1)A、B、C、D中均含有的同种元素在周期表中的位置是:
第三周期
第三周期
周期ⅡA
ⅡA
族;(2)写出D的电子式:
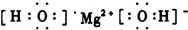
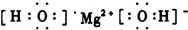
O=C=0
O=C=0
;z的空间构型:三角锥形
三角锥形
.(3)写出A+H2O
| △ |
Mg+2H2O
Mg(OH)2↓+H2↑
| ||
Mg+2H2O
Mg(OH)2↓+H2↑
;其反应类型:
| ||
置换反应
置换反应
.(2010?信阳二模)I.复分解反应是中学化学中常见的一种反应类型.
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律,请你判断下列反应不能成立的是
A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
①HClO4 ②CH3COOH ③HCN ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其他的规律.下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体请根据上述反应,总结出复分解反应发生的另一个规律:
将KI溶液与AgCl固体混合搅拌,固体变为黄色.该反应也遵循这一规律,请写出反应的化学方程式:
查看习题详情和答案>>
(1)已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质.依照该规律,请你判断下列反应不能成立的是
AD
AD
(填编号).A.CO2+H2O+2NaClO=Na2CO3+2HClO
B.CO2+H2O+NaClO=NaHCO3+HClO
C.CO2+H2O+C6H5ONa→NaHCO3+C6H5OH
D.CO2+H2O+2C6H5ONa→Na2CO3+2C6H5OH
E.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05mol/L的下列六种物质的溶液中,pH最小的是
⑤
⑤
(填编号),pH最大的是③
③
(填编号);①HClO4 ②CH3COOH ③HCN ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其他的规律.下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体
③蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体请根据上述反应,总结出复分解反应发生的另一个规律:
复分解反应能向着生成更难溶物质的方向进行
复分解反应能向着生成更难溶物质的方向进行
.将KI溶液与AgCl固体混合搅拌,固体变为黄色.该反应也遵循这一规律,请写出反应的化学方程式:
KI+AgCl=AgI+KCl
KI+AgCl=AgI+KCl
.