摘要:能证明某溶液中含有Fe2+的是( ) A.该溶液呈浅绿色 B.该溶液中加入NaOH溶液.生成白色沉淀并迅速变成灰绿色.最后变为红褐色 C.向该溶液中加入氯水.再滴入几滴KSCN溶液.呈红色 D.向该溶液中滴入几滴KSCN溶液.不变色.再加入氯水.呈红色 [解析]选BD.A中如果含有其他离子如铬酸氯也显示出浅绿色,C中如有Fe3+即可推翻, B.D两个选项是Fe2+的特征反应.
网址:http://m.1010jiajiao.com/timu_id_4020905[举报]
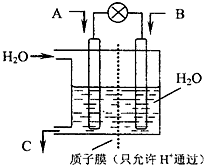 (2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
(2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.(1)下列措施中,有利于降低大气中的SO2、NOx、CO2浓度的有
acd
acd
(选填字母).a.减少化石燃料的使用,加快开发和利用风能、氢能等新能源
b.使用无磷洗涤用品,减少含磷废物的排放
c.多步行或乘公交车,少用专车或私家车
d.在屋顶安装太阳能热水器为居民提供生活用热水
(2)用甲醇替代作为汽车燃料可降低汽车尾气污染.已知用合成气(CO和H2)合成1mol液态甲醇吸收热量为131.9kJ,2H2(g)+CO2(g)+
| 3 | 2 |
△H=-594.1kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol
.(3)现欲以如图所示装置用电化学原理将CO2、SO2转化为重要化工原料.
①若A为CO2,B为H2,C为CH3OH则通入H2的一极为
负
负
极;②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
.(4)①已知:密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.
当此反应达到平衡时,若c(NO2)=0.030mol/L,则c(N2O4)=
0.012mol/L
0.012mol/L
(保留两位有效数字);②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是
升高温度
升高温度
. (2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(2010?福建)J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.(1)M的离子结构示意图为


ⅦA族
ⅦA族
族. (2)J和氢组成的化合物分子有6个原子,其结构简式为
CH2=CH2
CH2=CH2
.(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为
AlCl3+3H2O Al(OH)3+3HCl
Al(OH)3+3HCl
 Al(OH)3+3HCl
Al(OH)3+3HClAlCl3+3H2O Al(OH)3+3HCl
Al(OH)3+3HCl
. Al(OH)3+3HCl
Al(OH)3+3HCl(4)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为
2NH3?H2O+3H2O2=N2+8H2O
2NH3?H2O+3H2O2=N2+8H2O
.②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是
ac
ac
(选填序号).| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入N2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol
. (2010?卢湾区二模)丁子香酚可做香味剂,其结构简式如图所示:
(2010?卢湾区二模)丁子香酚可做香味剂,其结构简式如图所示:(1)丁子香酚的分子式为
C10H12O2
C10H12O2
.(2)丁子香酚不具有的性质是
ac
ac
(选填序号).a.易溶于水 b.通常状况下呈固态
c.可发生消去反应 d.遇FeCl3溶液显紫色
(3)丁子香酚与浓溴水可以发生的反应是:
取代反应、加成反应
取代反应、加成反应
(填有机反应类型);1mol丁子香酚与浓溴水反应时,最多可消耗Br22
2
mol.(4)丁子香酚有多种同分异构体,写出符合下列要求的两个同分异构体的结构简式:
①苯环上的一氯取代物为两种; ②遇FeCl3溶液显色; ③能发生银镜反应




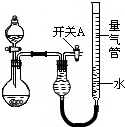 (2010?漳州二模)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)
(2010?漳州二模)某同学设计如图所示装置分别进行探究实验(夹持装置已略去)| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、稀HNO3 | H2O | |
| ② | NaOH固体、浓氨水 | NH3 | |
| ③ | Na2CO3固体、稀H2SO4 | CO2 | |
| ④ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(1)简述如何检查该装置的气密性:
关闭开关A和分液漏斗活塞,微热烧瓶,量气管左端液面升高,说明气密性良好
关闭开关A和分液漏斗活塞,微热烧瓶,量气管左端液面升高,说明气密性良好
.(2)该同学认为实验①可通过收集测量NO气体的体积,来探究Cu样品的纯度.你认为是否可行?请简述原因.
不可行.因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准
不可行.因为NO会与装置中空气反应后溶于水,使测得的NO气体体积不准
.(3)实验②、③中,量气管中的液体最好分别是
B
B
、D
D
.(只选一种)A.H2OB.CCl4C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(4)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②
使量气管两端液面相平
使量气管两端液面相平
,③视线与凹液面最低处相平.(5)实验④获得以下数据(所有气体体积均已换算成标准状况)根据上述合理数据计算镁铝合金中铝的质量分数
27%
27%
.
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 1.0g | 10.0mL | 347.5mL |
| 2 | 1.0g | 10.0mL | 335.0mL |
| 3 | 1.0g | 10.0mL | 344.5mL |
(2010?普陀区二模)硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
(一)实验室制取少量莫尔盐的流程如图:

试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是
(2)步骤3需要趁热过滤,原因是
(3)从步骤4到莫尔盐,必须进行的操作依次是
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式
(2)判断该反应到达滴定终点的现象为
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为
mol/L.
查看习题详情和答案>>
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是
除铁屑表面的油污
除铁屑表面的油污
;反应中铁屑过量是为了还原氧化生成的Fe3+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质
还原氧化生成的Fe3+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质
.(2)步骤3需要趁热过滤,原因是
FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4?7H2O析出
FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4?7H2O析出
.(3)从步骤4到莫尔盐,必须进行的操作依次是
过滤、洗涤
过滤、洗涤
,析出的晶体常用无水酒精或冰水
无水酒精或冰水
洗涤.(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是
B
B
(选填编号).A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O
.(2)判断该反应到达滴定终点的现象为
加入最后一滴KMnO4溶液紫红色不褪,且半分钟内不褪色
加入最后一滴KMnO4溶液紫红色不褪,且半分钟内不褪色
.(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为
| 1 |
| V |
| 1 |
| V |