摘要:常温条件下.相同的钠粒在30mL硫酸铜溶液中比在20mL纯水中反应更剧烈. 分析其原因.下列说法中最合理的是 ( ) A.Cu2+的氧化性比H+的强 B.硫酸铜溶液中的c(H+)比水中的大 C.硫酸铜溶液的体积比水的大 D.硫酸铜溶液中的SO42-更易与生成的Na+结合 [解析]选B.由题意可知.钠反应的原理主要决定于c(H+).因此B选项更趋向合理,A.C.D均 不合理.
网址:http://m.1010jiajiao.com/timu_id_4020902[举报]
(2010?重庆)某兴趣小组用图装置探究氨的催化氧化.

(1)氨催化氧化的化学方程式为
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是
(3)为保证在装置4中观察到红棕色气体,装置3应装入
(4)为实现氨催化氧化,也可用装置5替换装置
查看习题详情和答案>>

(1)氨催化氧化的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是
放热
放热
反应(填“吸热”或“放热”).(3)为保证在装置4中观察到红棕色气体,装置3应装入
浓H2SO4
浓H2SO4
;若取消3,在4中仅观察到大量白烟,原因是生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3
.(4)为实现氨催化氧化,也可用装置5替换装置
1
1
(填装置代号);化合物X为NH4Cl
NH4Cl
(只写一种),Na2O2的作用是与HCl反应生成氧气
与HCl反应生成氧气
.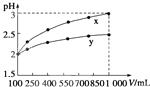 (2010?重庆)pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
(2010?重庆)pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
查看习题详情和答案>>
(2010?重庆)阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到E和R两种阻垢剂(部分反应条件略去)
(1)阻垢剂E的制备
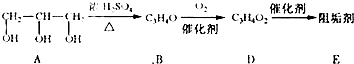
①A可由人类重要的营养物质
②B与新制的Cu(OH)2反应生成D,其化学方程式为
③D经加聚反应生成E,E的结构简式为
 .
.
(2)阻垢剂R的制备
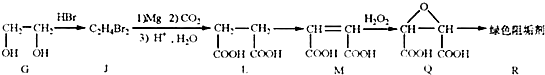
①G→J为取代反应,J的结构简式为
②J转化为L的过程中,L分子中增加的碳原子来源于
③由L制备M的反映步骤依次为:
HOOCCH2CH2COOH+HB的
HOOCCH2CHBrCOOH+HBr、
④1molQ的同分异构体T(碳链无支链)与足量NaHCO3溶液作用产生2molCO2,T的结构简式为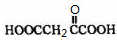 等
等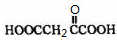 等(只写一种).
等(只写一种).
查看习题详情和答案>>
(1)阻垢剂E的制备
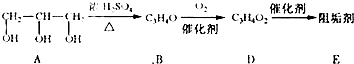
①A可由人类重要的营养物质
油脂
油脂
水解制得(填“糖类”、“油脂”或“蛋白质”).②B与新制的Cu(OH)2反应生成D,其化学方程式为
CH2=CHCHO+2Cu(OH)2
CH2=CHCOOH+Cu2O+2H2O
| △ |
CH2=CHCHO+2Cu(OH)2
CH2=CHCOOH+Cu2O+2H2O
.| △ |
③D经加聚反应生成E,E的结构简式为


(2)阻垢剂R的制备
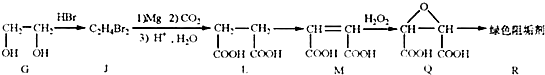
①G→J为取代反应,J的结构简式为
BrCH2CH2Br
BrCH2CH2Br
.②J转化为L的过程中,L分子中增加的碳原子来源于
CO2
CO2
.③由L制备M的反映步骤依次为:
HOOCCH2CH2COOH+HB的
| 催化剂 |
| △ |
HOOCCH2CHBrCOOH+3NaOH
NaOOCCH=CHCOONa+NaBr+3H2O
| 醇 |
| △ |
HOOCCH2CHBrCOOH+3NaOH
NaOOCCH=CHCOONa+NaBr+3H2O
、| 醇 |
| △ |
NaOOCCH=CHCOONa+H2SO4→HCOOCH=CHCOOH+Na2SO4
NaOOCCH=CHCOONa+H2SO4→HCOOCH=CHCOOH+Na2SO4
(用化学方程式表示)④1molQ的同分异构体T(碳链无支链)与足量NaHCO3溶液作用产生2molCO2,T的结构简式为
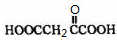 等
等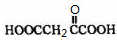 等
等(2010?重庆)钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2起始物质的量浓度为
mol/(L?min).
②工业制制硫酸,尾气SO2用
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示:
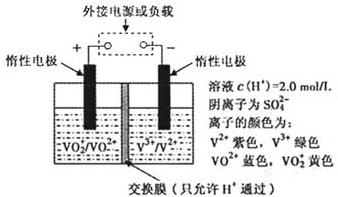
①当左槽溶液逐渐由黄变蓝,其电极反应式为
②充电过程中,右槽溶液颜色逐渐由
③放电过程中氢离子的作用是
查看习题详情和答案>>
(1)V2O5是接触法制硫酸的催化剂.
①一定条件下,SO2与空气反应t min后,SO2和SO3物质的量浓度分别为a mol/L,b mol/L,则SO2起始物质的量浓度为
a+b
a+b
mol/L;生成SO3的化学反应速率为| b |
| t |
| b |
| t |
②工业制制硫酸,尾气SO2用
氨水
氨水
吸收.(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示:

①当左槽溶液逐渐由黄变蓝,其电极反应式为
VO2++2H++e-=VO2++H2O
VO2++2H++e-=VO2++H2O
.②充电过程中,右槽溶液颜色逐渐由
绿
绿
色变为紫
紫
色.③放电过程中氢离子的作用是
参与正极反应
参与正极反应
和通过交换膜定向移动使电流通过溶液
通过交换膜定向移动使电流通过溶液
;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol
0.5mol
.