摘要:⑴Al2O3 + Na2CO32NaAlO2 +CO2↑,SiO2 +Na2CO3 Na2SiO3 + CO2↑ ⑵由于溶液在硅酸钠和偏铝酸钠发生水解.SiO32-+H2OHSiO3-+OH-,HSiO3-+H2OH2SiO3+OH-,AlO2-+H2OAl(OH)3+OH-,降低pH值有利于平衡向正反应方向移动.当pH调到7-8时.使它们水解完全. ⑶2CrO42-+2H+ Cr2O72-+H2O ⑷①当滴加最后一滴硫代硫酸钠溶液.溶液蓝色褪去 ②94.08%
网址:http://m.1010jiajiao.com/timu_id_4016404[举报]
 新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
| ||
(1)从原料角度分析,AlN中的杂质可能是
(2)装置B中的试剂是
(3)充分反应后,需打开K通入一段时间N2,其目的是
(4)下列针对该实验的各项措施中,不能提高测定结果准确度的是
a.在加入NaOH溶液之前,排净装置内的氧气
b.滴加NaOH溶液不宜过快
c.取消B装置
d.在C之后增添盛有碱石灰的干燥管
(5)实验中准确称取m g的样品三份,进行三次测定,测得实验前后装置C平均增重n g,则样品中AlN的纯度为
(6)实验证明,用上图装置测定的AlN纯度偏高,原因是
 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.(1)铁元素在元素周期表中的位置是
第四周期第VIII族
第四周期第VIII族
.(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示.
①该电池的总反应化学方程式为
4Al+3O2+6H2O=4Al(OH)3
4Al+3O2+6H2O=4Al(OH)3
;②电池中NaCl的作用是
增强溶液的导电能力
增强溶液的导电能力
.(3)用铝电池电解CuSO4溶液(电极均为铂电极),通电一段时间后,一极上析出红色固体,另一极的电极反应式为
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
,此时向溶液中加入8g CuO固体后可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为1.12
1.12
L.(4)氯化铝广泛用于有机合成和石油工业的催化剂.将铝土矿粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式
Al2O3+3C+3Cl2
2AlCl3+3CO.
| ||
Al2O3+3C+3Cl2
2AlCl3+3CO.
.
| ||
(5)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末,常用作颜料.已知氧化亚铜溶于稀硫酸生成Cu和CuSO4.取少量Fe2O3和Cu2O组成的混合物放入足量稀硫酸中.
①此过程中发生的反应有(用离子方程式表示):
Fe2O3+6H+=2Fe3++3H2O;
Cu2O+2H+=Cu+Cu2++H2O
Cu2O+2H+=Cu+Cu2++H2O
;Cu+2Fe3+=2Fe2++Cu2+
Cu+2Fe3+=2Fe2++Cu2+
②设计实验证明反应后所得溶液中铁元素可能存在形式
取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子
取少量所得溶液于试管中,向其中滴加硫氰化钾溶液,若溶液变红则说明存在铁离子,反之则无,另取少量所得溶液于试管中,向其中滴加酸性高锰酸钾溶液,溶液褪色说明含有亚铁离子,不褪色说明没有亚铁离子
.③若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O)
>
>
n(Fe2O3).(填“>”、“<”或“=”)(2011?龙岩模拟)“分子筛”可作为催化剂、催化剂载体或吸附剂.以高岭土(主要成分为Al2O3、SiO2等)、石灰石、海水为原料生产“分子筛”的工艺流程如图所示.回答下列问题:
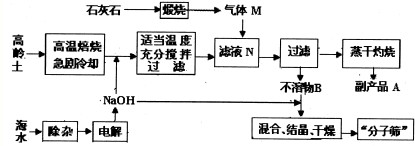
(1)海水中含Mg2+、Ca2+和SO2-4杂质.为制取NaOH,杂质离子必须除去.“除杂”时需按一定顺序加入下列试剂:①过量的NaOH溶液;②过量的Na2CO3溶液;③适量的盐酸;④过量的BaCl2溶液.正确的添加顺序是
(2)气体M(过量)和滤液N生成B的离子方程式是
(3)写出副产物A溶于水所得溶液中各离子浓度从大到小的顺序为
(4)上述流程中可以循环利用的物质是
(5)已知:某高岭土中Al2O3的质量分数为35%,则1t高岭土在理论上可制得化学式为Na2O?Al2O3?2SiO2?9/2H2O(Al2O3的质量分数为28%)的分子筛
查看习题详情和答案>>

(1)海水中含Mg2+、Ca2+和SO2-4杂质.为制取NaOH,杂质离子必须除去.“除杂”时需按一定顺序加入下列试剂:①过量的NaOH溶液;②过量的Na2CO3溶液;③适量的盐酸;④过量的BaCl2溶液.正确的添加顺序是
④①②③或①④②③;
④①②③或①④②③;
.要使Ca2+完全沉淀(即溶液中c(Ca2+)<1×10-5mol/L),溶液中c(CO2-3)应不小于2.9×10-4mol/L
2.9×10-4mol/L
已知 Ksp(CaCO3)=2.9×10-9).(2)气体M(过量)和滤液N生成B的离子方程式是
SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
.(3)写出副产物A溶于水所得溶液中各离子浓度从大到小的顺序为
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
.(4)上述流程中可以循环利用的物质是
CO2
CO2
.(5)已知:某高岭土中Al2O3的质量分数为35%,则1t高岭土在理论上可制得化学式为Na2O?Al2O3?2SiO2?9/2H2O(Al2O3的质量分数为28%)的分子筛
1.25
1.25
t.
【化学--选修2:化学与技术】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请回答下列问题:
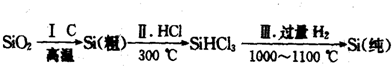
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
①写出步骤I的化学方程式: .
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是 .
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式: .
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明: _、 .
(4)高分子材料.它可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂[AlFe(OH)nCl6-n]m就属于无机高分子材料,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为 ;一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式: .
(5)合金材料.14g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为 g.
查看习题详情和答案>>
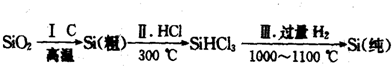
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
①写出步骤I的化学方程式:
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
(4)高分子材料.它可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂[AlFe(OH)nCl6-n]m就属于无机高分子材料,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为
(5)合金材料.14g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12L(标准状况下)O2混合通入水中,恰好全部被水吸收,则合金中铜的质量为
(2012?河西区一模)下图中D、E、Z是单质,其余均是化合物.且知D、E为日常常用金属;D元素的原子最外层电子数与电子层数相等{无色气体N在Z中燃烧生成气体X;N、Z、Y是氯碱工业的产品;除反应①外,其他反应均在水溶液中进行.

请按要求回答下列问题:
(1)D在周期表中的位置:
 .
.
(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
(3)写出反应①的化学方程式:
(4)上图反应中不属于氧化还原反应的是(填编号)
(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:

查看习题详情和答案>>

请按要求回答下列问题:
(1)D在周期表中的位置:
第三周期,第ⅢA族
第三周期,第ⅢA族
;X的电子式为

(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
AlO2-+2H2O=Al(OH)3胶体+OH-
AlO2-+2H2O=Al(OH)3胶体+OH-
.(3)写出反应①的化学方程式:
2Al+3FeO
Al2O3+3Fe
| ||
2Al+3FeO
Al2O3+3Fe
.在B溶液中滴加黄色K3[Fe(CN)6]溶液,可观察到的现象是
| ||
生成有特征蓝色的沉淀
生成有特征蓝色的沉淀
.(4)上图反应中不属于氧化还原反应的是(填编号)
④⑦⑧⑨
④⑦⑧⑨
.(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:
