网址:http://m.1010jiajiao.com/timu_id_4011154[举报]

(1)X与B反应的离子方程式为
(2)D溶液pH值大于7,原因是(用离子方程式表示)
 HCO3-+OH-HCO3-+H2O?H2CO3+OH-
HCO3-+OH-HCO3-+H2O?H2CO3+OH- HCO3-+OH-HCO3-+H2O?H2CO3+OH-
HCO3-+OH-HCO3-+H2O?H2CO3+OH-(3)写出C与过量B反应(加热)的离子方程式
| ||
| ||
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序
(5)Y在同主族的同类物质中分子稳定性最强
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1,△H2,△H3,则三者由大到小排序为:
(14分)现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:
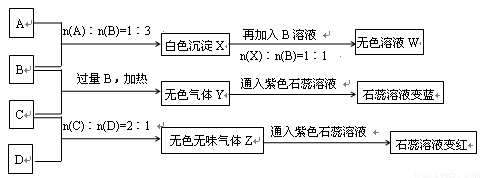
(1)X与B反应的离子方程式为 。
(2)D溶液pH值大于7,原因是(用离子方程式表示) 。
(3)写出C与过量B反应(加热)的离子方程式 __________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________.
(5)Y在同主族的同类物质中分子稳定性最强( ),也是沸点最高的( )。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为 △H1 ,△H2 ,△H3 ,则三者由大到小排序为:___________________.
查看习题详情和答案>>
(14分)现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:
(1)X与B反应的离子方程式为 。
(2)D溶液pH值大于7,原因是(用离子方程式表示) 。
(3)写出C与过量B反应(加热)的离子方程式 __________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________.
(5)Y在同主族的同类物质中分子稳定性最强( ),也是沸点最高的( )。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为 △H1 ,△H2 ,△H3 ,则三者由大到小排序为:___________________.
查看习题详情和答案>>
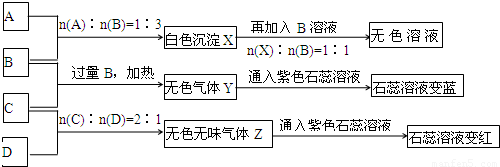
(14分)现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答: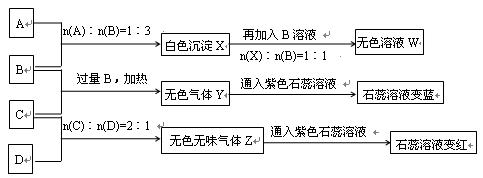
(1)X与B反应的离子方程式为 。
(2)D溶液pH值大于7,原因是(用离子方程式表示) 。
(3)写出C与过量B反应(加热)的离子方程式 __________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________.
(5)Y在同主族的同类物质中分子稳定性最强( ),也是沸点最高的( )。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1 ,△H2,△H3 ,则三者由大到小排序为:___________________.
(1)X与B反应的离子方程式为 .
(2)D溶液pH值大于7,原因是(用离子方程式表示) .
(3)写出C与过量B反应(加热)的离子方程式 .
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序 .
(5)Y在同主族的同类物质中分子稳定性最强 ,也是沸点最高的 .(判断正误填“是“或“否“)
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1,△H2,△H3,则三者由大到小排序为: . 查看习题详情和答案>>