网址:http://m.1010jiajiao.com/timu_id_4009957[举报]
(深圳新安中学2008-2009学年第一学期期末)高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从以上表格中判断以下说法中不正确的是:
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
查看习题详情和答案>>(9分)
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题: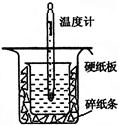
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。 查看习题详情和答案>>
(9分)
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:

(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
|
滴定次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
|
滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
|
第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
|
第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
|
第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
查看习题详情和答案>>
Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
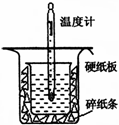
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
查看习题详情和答案>>A.坩埚 B.容量瓶 C.试管 D.托盘天平 E.玻璃棒
①其中仪器上标示出仪器的使用温度的
②称取 10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为
(2)若要配制500mL 1mol/L NaOH溶液时,下列哪些操作会使实验结果偏高的是
A.定容,振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未使用游码)
C.原容量瓶洗涤后未干燥
D.定容时俯视刻度线
E.移液时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中.