网址:http://m.1010jiajiao.com/timu_id_4009935[举报]
 (2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②该反应的平衡常数表达式为
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
③其它条件不变,下列措施中能使
n(CH3OH)/n(CO2)增大的是
A.升高温度 B.再充入1mol CO2和3mol H2
C.将H2O(g)从体系中分离 D.充入He(g),使体系压强增大
(2)CO2是典型的酸性氧化物,能转化为其它物质.
①利用CO2可制得纯碱,纯碱溶液PH
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-②一定温度下,在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,观察到的现象是
 Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动 Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动(3)在载人航天器的生态系统中,不仅要求分离除去CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为:
(11分)(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)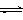 CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1mol H2 |
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来
 消除CO的污染。请你判
消除CO的污染。请你判 断是否可行并说出理由: , 。
查看习题详情和答案>>
断是否可行并说出理由: , 。
查看习题详情和答案>>
(11分) (1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由: , 。
查看习题详情和答案>>
(11分) (1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由: , 。
查看习题详情和答案>>
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ,△H=-49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,平均反应速率v(CO2)= mol/(L·min)。
②该反应的平衡常数表达式为________________________________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为: 。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由: , 。
查看习题详情和答案>>