摘要:5.下表是周期表的一部分.试回答下列问题: ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 2 ① ② 3 ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ 4 ⑩ ⑾ ⑿ ⑴写出下列元素的符号:① ② ⑦ ⑩ ⑵这些元素中.第一电离能最小的是 .电负性最大的元素是 ⑶在这些元素的最高价氧化物对应水化物中.酸性最强的是 .碱性最强的是 .呈两性的氢氧化物是 .写出三者之间相互反应的离子方程式: ⑷在这些元素中.原子半径最小的是 .原子半径最大的是
网址:http://m.1010jiajiao.com/timu_id_4006278[举报]
下图是周期表的一部分,试回答下列问题:
(1)元素②有两种原子10X和9X,下列说法正确的是______
a.是同一种核素 b.具有相同的中子数
c.几乎具有相同的化学性质 d.具有相同的物理性质
①与⑦具有相似的化学性质,写出①的氯化物水解反应的化学方程式______.
(2)⑩和(11)两元素形成的某化合物可作为干燥剂,试写出其电子式______.
(3)③④⑤⑥四种元素氢化物的沸点由低到高排列为______(用元素符号表示).
(4)元素⑨X的单质和元素④Y的最高价氧化物的水化物反应的还原产物为YO和YO2,且YO和YO2的物质的量之比为1:1,写出该反应的化学方程式______.
(5)⑧号元素M形成的盐K2MO4是一种强氧化剂,可作为水处理剂和高容量电池的材料.与MnO2-Zn电池相似,K2MO4-Zn也可以组成碱性电池,其正极反应式为______总反应的离子反应式为______.
查看习题详情和答案>>
| ① | ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||||
| ⑦ | ⑩ | |||||||||||||||||||
| ⑾ | ⑧ | ⑨ | ||||||||||||||||||
a.是同一种核素 b.具有相同的中子数
c.几乎具有相同的化学性质 d.具有相同的物理性质
①与⑦具有相似的化学性质,写出①的氯化物水解反应的化学方程式______.
(2)⑩和(11)两元素形成的某化合物可作为干燥剂,试写出其电子式______.
(3)③④⑤⑥四种元素氢化物的沸点由低到高排列为______(用元素符号表示).
(4)元素⑨X的单质和元素④Y的最高价氧化物的水化物反应的还原产物为YO和YO2,且YO和YO2的物质的量之比为1:1,写出该反应的化学方程式______.
(5)⑧号元素M形成的盐K2MO4是一种强氧化剂,可作为水处理剂和高容量电池的材料.与MnO2-Zn电池相似,K2MO4-Zn也可以组成碱性电池,其正极反应式为______总反应的离子反应式为______.
查看习题详情和答案>>
下表为周期表的一部分,其中的字母代表对应的元素
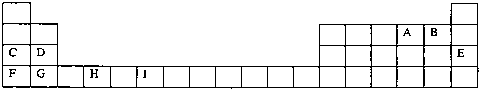
请回答下列问题:
(1)写出元素I的基态原子的价电子排布式 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)请列举F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值高,其原因是 .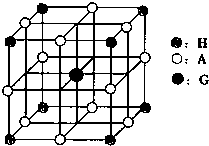
(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为 ;在该晶体中,G离子的配位数为 ;若晶胞的边长为acm,则晶体的密度为 g/cm3.
查看习题详情和答案>>

请回答下列问题:
(1)写出元素I的基态原子的价电子排布式
(2)请列举F的金属性比C强的实验事实:
(3)在标准状况下,根据M=
| m | n |

(4)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如图,则该晶体的化学式为
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
(1)a的氢化物的分子构型为
三角锥形
三角锥形
,中心原子的杂化形式为sp3
sp3
;d在空气中燃烧产物的分子构型为V形
V形
,中心原子的杂化形式为sp2
sp2
,该分子是极性
极性
(填“极性”或“非极性”)分子.(2)b、d、e三种元素的氢化物中的沸点最高的是
HF
HF
,原因是:HF分子间形成氢键,HCl、H2S分子间没有氢键
HF分子间形成氢键,HCl、H2S分子间没有氢键
.(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.此配合离子空间构型为
平面正方形
平面正方形
,请写出生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+
Cu2++4H2O=[Cu(H2O)4]2+
.(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为
[Co(NH3)5SO4]Br
[Co(NH3)5SO4]Br
,该配合物的配体是NH3
NH3
、SO42-
SO42-
;(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
c单质晶体中原子的配位数为
12
12
.若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为| M | ||
4
|
| M | ||
4
|
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)表中属于d区的元素有

(2)写出元素L的基态原子的电子排布式
(3)某元素的特征电子排布式为(n+1)sn(n+1)pn-1,在上周期中,与该元素为对角线关系的元素形成的单质与氢氧化钠溶液反应的离子方程式
(4)比较M的氢化物与同族第二周期元素所形成的氢化物稳定性由高到低的顺序为
查看习题详情和答案>>
| A | |||||||||||||||||
| B | C | D | E | ||||||||||||||
| F | G | H | I | ||||||||||||||
| J | K | L | M | ||||||||||||||
(1)表中属于d区的元素有
J K L
J K L
(填所选字母).用电子式表示G和I形成的化合物的形成过程:

(2)写出元素L的基态原子的电子排布式
1S22S22P63S23P6 3d104s1
1S22S22P63S23P6 3d104s1
.(3)某元素的特征电子排布式为(n+1)sn(n+1)pn-1,在上周期中,与该元素为对角线关系的元素形成的单质与氢氧化钠溶液反应的离子方程式
Be+2OH-=BeO22-+H2↑
Be+2OH-=BeO22-+H2↑
(4)比较M的氢化物与同族第二周期元素所形成的氢化物稳定性由高到低的顺序为
NH3>AsH3
NH3>AsH3
(用化学式表示),并说明理由同主族从上到下原子半径依次增大,氢化物的稳定性同主族从上到下非金属性减弱,氢化物稳定性减弱
同主族从上到下原子半径依次增大,氢化物的稳定性同主族从上到下非金属性减弱,氢化物稳定性减弱
.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出字母O代表的元素符号
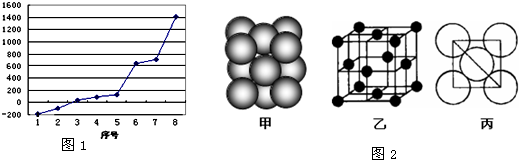
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(4)k与l形成的化合物kl2的电子式是
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于
(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
(用M、NA、d表示).
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||

试回答下列问题:
(1)请写出字母O代表的元素符号
Fe
Fe
,该元素在周期表中的位置第四周期第 VIII族
第四周期第 VIII族
.(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填如图1中的序号).(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(4)k与l形成的化合物kl2的电子式是


分子
分子
晶体.(5)i单质晶体中原子的堆积方式如图2(甲)所示,其晶胞特征如图2(乙)所示,原子之间相互位置关系的平面图如图2(丙)所示.若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
一个晶胞中i原子的数目为
4
4
,该晶体的密度_
| ||
| 8NAd3 |
| ||
| 8NAd3 |
(6)a与d构成的阳离子和i的阳离子可与硫酸根形成一种复盐,向该盐的浓溶液中逐滴加入浓氢氧化钡溶液,产生的现象有:①溶液中出现白色沉淀并伴有有刺激性气味气体放出,②沉淀逐渐增多后又逐渐减少直至最终沉淀的量不变.写出沉淀的量不变时发生反应的离子方程式
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
NH4++Al3++5OH-+2SO42-+2Ba2+=NH3↑+3H2O+AlO2-+2BaSO4↓
.